|
Tổng quan đa hình đột biến gen K13 và những phát hiện mới về góc độ sinh học phân tử
Sốt rét hiện vẫn là vấn đề y tế công cộng quan trọng tại các quốc gia và vùng lãnh thổ nhiệt đới, với tỷ lệ mắc và tỷ lệ tử vong cao, đặc biệt là ở vùng nhiệt đới châu Phi và Đông Nam Á, trong đó có Việt Nam. Trong năm 2013, theo thống kê của Tổ chức Y tế thế giới (WHO), có khoảng 3,3 tỷ người sống trên 97 quốc gia và vùng lãnh thổ có nguy cơ bị nhiễm sốt rét với gần 600.000 ca tử vong do sốt rét (TVSR) hoặc có liên quan đến sốt rét và cứ mỗi 45 giây lại có trẻ em chết do liên quan đến sốt rét. Với khoảng 90% ca TVSR xảy ra ở châu Phi, chủ yếu là do loài P. falciparumthì việc WHO đã cảnh báo về sự xuất hiện của ký sinh trùng sốt rét P. falciparum kháng artemisinins (một thành phần chính trong hợp chất chủ yếu của ACTs, loại thuốc ưu tiên hàng đầu trong điều trị sốt rét P. falciparum tại các quốc gia có sốt rét lưu hành (SRLH) ở biên giới Campuchia và Thái Lan trong giai đoạn 2006-2007 qua các thử nghiệm in vitro và in vivo được nhấn mạnh là một mối đe dọa tiềm ẩn đối với công tác phòng chống và loại bỏ sốt rét trên toàn thế giới. Tiếp đó, đến cuối năm 2008 và đầu năm 2009, các thông báo từ TCYTTG cho biết tại một số vùng ở Campuchia cho thấy artemisinin giảm nhạy và bị kháng do loài P. falciparum và tại những khu vực này đã xuất hiện chủng ký sinh trùng sốt rét kháng với các thuốc cổ điển (mefloquin, chloroquin, sulfadoxine/pyrimethamine). Đến năm 2009-2014, các nghiên cứu dựa vào bằng chứng cho thấy chậm làm sạch ký sinh trùng và đột biến gen K13 propeller ở P. falciparum đã kháng với các thuốc phối hợp có thành phần thuốc artemisinins hoặc dẫn suất (Artemisinine-based combination therapies_ACTs) tại phía Tây Campuchia2 và đến nay có ít nhất 6 quốc gia có xuất hiện kháng, gồm Campuchia, Thái Lan3–5, Việt Nam6, Myanmar7,8, Lào, Bangladesh9 và Ấn Độ7. Đồng thời, tại các quốc gia này đã phát hiện tính đa hình đột biến K13 được cho là có liên quan (associated) hoặc xác định (confirmed) kháng với thuốc artemisinins. Điều này có thể de dọa đến thành quả công tác phòng chống và loại trừ sốt rét trong khu vực và trên phạm vi toàn thế giới. 
Bên cạnh đó, song song với sự chuyển dịch cơ cấu ký sinh trùng sốt rét trên toàn cầu với P. falciparum 54% và P.vivax 46%; (WHO, 2015) thì tại Việt Nam, đặc biệt khu vực miền Trung-Tây Nguyên, cơ cấu KSTSR cũng thay đổi với tỷ lệ P. falciparum và P. vivax gần tương đương hoặc thậm chí P. vivax cao hơn so với P. falciparum ở một số điểm nóng các tỉnh (Gia Lai, Đăk Nông, Khánh Hòa). Đây sẽ là trở ngại nghiêm trọng trong tiến trình loại trừ sốt rét tại Việt Nam. Kháng thuốc Artermisinin Thuốc artemisinins được sản xuất năm 1972 và sau đó có một số dẫn suất artemisinin ra đời đưa vào điều trị SR do P. falciparum. Thuốc có tác dụng dụng diệt KSTSR nhanh và cải thiện lâm sàng trong vòng 30-40 giờ. Tuy nhiên, trong giai đoạn 2006-2007, TCYTTG đã cảnh báo cộng đồng quốc tế về sự xuất hiện P. falciparum kháng artermisinin ở biên giới Campuchia-Thái Lan (2009), sau đó là Việt Nam, Myanmar (2010) và Lào (2013) và đến nay đã đạt mức báo động ở nhiều quốc gia trong tiểu vùng sông Mê Kông (WHO, 2015 1) cũng như đến các quốc gia ngoài châu lục và thậm chí sang các quốc gia châu Phi và Nam Mỹ. Quá trình hình thành và phát triển kháng thuốc có thể chia thành hai yếu tố góp phần: một là các yếu tố liên quan đến di truyền phát sinh, hình thành các đột biến kháng và thứ hai là quá trình chọn lọc kháng do lan truyền đột biến kháng, nên kháng sẽ có nguy cơ lan rộng là khó tránh khỏi. 
Kháng artemisinin trong lâm sàng được mô tả là tình trạng chậm làm sạch KSTSR thể vô tính sau khi điều trị với artesunate đơn trị liệu, hoặc phương pháp điều trị kết hợp dựa trên thành phần hoạt chất chính artemisinin (Artemisinine-based combination therapies_ACTs). Hiện tượng ký sinh trùng sốt rét dương tính vào ngày D3 được định nghĩa là sự tồn tại ký sinh trùng sốt rét dưới kính hiển vi phát hiện vào ngày thứ 3 sau khi điều trị với ACTs1. Định nghĩa mới của kháng artemisinin theo TCYTTG qua thời gian nghiên cứu có cập nhật (2010-2014) như là sự gia tăng thời gian làm sạch ký sinh trùng sốt rét, tương ứng tỷ lệ D3 ≥ 10% số trường hợp có ký sinh trùng sốt rét được phát hiện vào ngày thứ 3 sau khi điều trị bằng ACTs (nghi ngờ kháng); hay thất bại điều trị sau khi điều trị đơn thuần với artemisinin với nồng độ thích hợp trong máu, bằng chứng là sự tồn tại của ký sinh trùng sốt rét sau 7 ngày điều trị, hoặc sự hiện diện của ký sinh trùng sốt rét vào ngày thứ 3 và tái phát trong vòng 28/42 ngày (xác định kháng) hoặc gần đây có bổ sung các tiêu chí về đột biến kháng gen K13 propeller. 
Phương pháp điều trịACTstheo khuyến cáo của TCYTTGlà liệu pháp thuốc ưu tiên đối với cácca SRdoP. falciparum. Loại thuốc này đem lại thành công đáng kể trong việc giảm tỷ lệ tử vong doSRtrên toàn cầu trong những năm qua.Tuy nhiên, P. falciparumcó một khả năng kháng với thuốcSR bằng sự tiến hóa thích nghi, do đó hiệu quả ACTs đang bị đe dọa bởi việc xuất hiệnký sinh trùng sốt rétkháng artemisinin. Sự đề kháng của chủng P. falciparumvới artemisinin và dẫn xuấthiện nay đã xuất hiện tại phía Campuchia, Thái Lan, Việt Nam, Myanmar và Lào.Do đó, vấn đề cấp thiết đặt ra là cần phải tìm ra các yếu tố di truyền củaký sinh trùng sốt rétliên quan đếnkháng artemisinin và xác địnhchỉ điểmphân tử để giám sát sự lan rộng kháng artermisinin. 
Tại Đông Nam Á, tình trạng chậm làm sạch ký sinh trùng sốt rét và kháng artermisinine đang phát triển phức tạp. Từ năm 2013, TCYTTG đưa ra các khuyến cáo khẩn cấp về tình hình kháng artemisinin như “một bệnh mới nổi” tại tiểu vùng sông Mê Kông và tỷ lệ tồn tại ký sinh trùng sốt rét ngày D3 được ghi nhận trên 10%. Đặc biệt, tại Campuchia, sau khi thực hiện ngăn chặn sốt rét năm 2009, số ca sốt rét P. falciparum đã giảm, nhưng tỷ lệ ca sau khi được điều trị với DHA-PPQ tồn tại ký sinh trùng sốt rét ngày D3 tăng từ 26% đến 45%, từ năm 2008 đến 2010; song song với sự gia tăng thất bại trong điều trị với DHA-PPQ được báo cáo từ 2008-2013. Tại Myanmar, P. falciparum kháng artemisinin được được báo cáo tại khu vực biên giới Myanmar-Thái Lan từ nhiều năm trước và tình trạng chậm làm sạch ký sinh trùng sốt rét sau khi điều trị với ACTs cũng được xác định ở miền Nam quốc gia Myanmar trong những năm gần đây (Kyaw MP và cs., 2013)11. Hiện tượng chậm làm sạch KST tại Việt Nam Khu vực miền Trung-Tây Nguyên là khu vực trọng điểm sốt rét với trên 50% số mắc và 90% tử vong sốt rét hàng năm so với cả nước, đặc biệt chủng P. falciparum đa kháng thuốc và có xu hướng giảm đáp ứng với thuốc phối hợp ACTs cũng như các dẫn suất artemisinin. 
Tương tự như các quốc gia có SRLH khác trong khu vực tiểu vùng sông Mê Kông, cho đến trước 2009, tại Việt Nam kháng thuốc cũng đã được ghi nhận với tất cả thuốc sốt rét, ngoại trừ artemisinine và các dẫn suất. Phối hợp DHA-PPQ chứng minh có hiệu lực cao trong điều trị sốt rét do P. falciparum và là công cụ hữu ích tại các vùng SRLH ở Việt Nam. Tuy nhiên DHA-PPQ trong nghiên cứu thử nghiệm lâm sàng tại Việt Nam tại những vùng SRLH nặng, có thể đa kháng thuốc ở Quảng Trị, Ninh Thuận, Bình Phước, Gia Lai, Quảng Nam, Đăk Nông, Đăk Lăk trong thời gian từ năm 2011-2015 cho kết quả đáp ứng lâm sàng và ký sinh trùng sốt rét đầy đủ (ACPR) rất cao, song có một tỷ lệ nhỏ thất bại điều trị muộn. Bên cạnh đó, tại nhiều tuyến bệnh viện điều trị khu vực miền Trung-Tây Nguyên trong thời gian từ 2007-2011 đã ghi nhận nhiều ca sốt rét do P. falciparum và / hoặc nhiễm phối hợp P. falciparum với một loài khác điều trị bằng DHA-PPQ cho kết quả còn tồn tại KST vào ngày D3 sau khi kết thúc liệu trình 3 ngày, bất luận có ghi nhận về dung nạp hoặc không và một số yếu tố có thể ảnh hưởng lên hiệu quả điều trị cho các BNSR tại hệ điều trị, cho thấy hiệu lực DHA-PPQ phần nào đã giảm, đặc biệt là khâu làm sạch KST qua các cuộc giám sát đánh giá chất lượng chẩn đoán và điều trị. Dẫn liệu còn cho thấy nhiều thử nghiệm lâm sàng in vivo tại Bình Phước vào năm 2008-2011 và tại Gia Lai vào 2010-2011 đánh giá phác đồ AS đơn trị liệu và DHA-PPQ, theo dõi 28/ 42 ngày với nhiều cỡ mẫu khác nhau cho thấy tỷ lệ D3(+) khoảng 20% (WHO, 2012).Việc đánh giá đáp ứng P. falciparum với các phác đồ phối hợp ACTs trên BNSR do P. falciparumlà hết sức cần thiết trước khi kháng thuốc xảy ra thật sự. Hiện tượng chậm làm sạch KST sau khi điều trị DHA-PPQ tại Việt Nam lần đầu tiên được phát hiện tại Bình Phước (2009). Giám sát thường quy trong năm 2011 với DHA-PPQ cũng phát hiện hiện giảm nhạy với artemisinin ở Gia Lai tỷ lệ tồn tại KST ngày D3 tăng từ 18% lên đến 38.5% ngày D3 và ngày D4 là 23,1% trong năm 2013; tại tỉnh Đắk Nông và Quảng Nam (2012) lần lượt 23.4% và 21%. Một nghiên cứu khác từ 2012-2013 tại Quảng Nam tỷ lệ tồn tại KST dương tính ngày D3là khoảng 30% và thời gian làm sạch ½ số lượng KST (parasite clearance half-life là 6.2 giờ (IQR) (4,4-5,5 giờ) tăng so với nghiên cứu trước đây tại khu vực miền Trung Việt Nam là 2,9 giờ 6. Hiện tượng kéo dài thời gian làm sạch KSTSR so với các nghiên cứu trước đây tại châu Phi và Đông Nam Á có thể đóng vai trò như một chỉ điểm lâm sàng gián tiếp của thất bại điều trị hoặc kháng với DHA-PPQ. Việc phát hiện hiệu lực thuốc giảm không chỉ là bước đầu tiên phổ cập các thông tin hữu ích cho công tác kiểm soát SR, mà còn đưa ra các bằng chứng để xây dựng kế hoạch và chính sách thuốc với sự phối hợp toàn cầu để ngăn chặn và loại trừ SR trên toàn thế giới. Các chỉ điểm (marker) phân tử đột biến K13 propeller Mối liên quan giữa đột biến gen K13 propeller đối với kháng artemisinin đang được các nhà khoa học quan tâm. Đa hình các đột biến gen K13 được xác định có mặt tại nhiều tỉnh tại Campuchia và gần đây được báo cáo tại nhiều nơi nữa trên thế giới, đặc biệt khu vực tiểu vùng sông Mê Kông (Myanmar, Thái Lan, Việt Nam, Bangladesh, Ấn Độ). Sự liên quan chặt chẽ giữa allen đột biến với tỷ lệ sống sót của ký sinh trùng sốt rét trong thử nghiệm in vitro và hiện tượng chậm làm sạch ký sinh trùng sốt rét trên in vivo, cho thấy chỉ điểm đột biến K13 propeller hiện là một chỉ điểm quan trọng trong kháng artemisinins (Federic và cs., 2014)2. 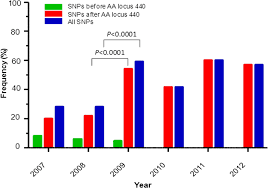
Liên quan đa hìnhđột biếngen K13, trên gen PF3D7_1343700, domain Kelchpropeller (K13- propeller) đã được ứng dụng như một chỉ thị hay chỉ điểm phân tử để xác định kháng artemisinin trong các thử nghiệm in vivovàin vitro vì một số lý do: -Có sự mất liên tiếp những chủng ký sinh trùng sốt rét kiểu hoang dại ởphía Tây Campuchia suốt giaiđoạn bắt đầu có sự kháng artemisinin; -Kiểu ký sinh trùng sốt rét đột biếntăng lên về tần số tại các vùng kháng thuốc của Campuchia và xuất hiện rất ít ở những nơi kháng artemisinin là không phổ biến; -Gen PF3D7_1343700nằm trong vùngdấu hiệu ưu tiên để chọn lọc; -Những đột biến đa dạng trên vùng K13-propellerphản ánh chọn lọc dương; -Những đột biến xảy ra trênvùng gen có tính bảo tồn cao củaP. falciparum,chỉ có mộtđột biến đa hình đơn nucleotidedạng SNPs (single nucleotide polymorphism) được ghi nhậntừ một phân lậpở châu Phi; -Tất cả các kiểu đa hình được quan sát là khác thường(trừ kiểu V568G); -Có 3 đột biến có tần số cao nhất trong gen K13có mối liên quan chặt chẽ với tỷ lệ RSA0-3htrongnghiên cứu thử nghiệm invitro trên các mẫu phân lậpvà thời gian làm sạch50% số lượngKSTSRtrên bệnh nhân; -Tần xuất xuất hiện của những alen đột biến tương quan mạnh với tỷ lệ KSTSR dương tính ngày D3sau khi điều trị bằng thuốc ACTs. Gen K13 hay Kelch 13 propeller domain gồm có 3 domain với 225 acid amin: -Một domain có đầu N có tính chất bảo tồn đặc trưng cho loài Plasmodium sp., -Một domain BTB/POZ; -Phía đầu C với 6 domain hình cánh quạt điển hình cho motif Kelch. Motif Kelch chứa protein được bảo tồn qua tiến hóa giữa các loài khác nhau và nhóm lại thành loại protein KLHL. Vậtchủ là người chứa 42 protein trong protein KLHL. 
Cho đến này trong tổng số 186 allen trên vùng K13, có 180 đột biến không tương đồng - đột biến làm thay đổi biểu hiện gen và kiểu hình của cá thể. Trong khu vực Đông Nam Á, đã quan sát được các allen lạ, có nguồn gốc từ “ sự trổi dậy” có tính chất đa dạng và độc lập. 
Tại một số quốc gia thuộc khu vực tiểu vùng sông Mê Kông như Campuchia, Lào và Việt Nam, các đột biến thường xuyên xuất hiện là C580Y, R539T, Y493H và I543T. Tại các quốc gia khu vực phía Tây bao gồm Trung Quốc, Myanmar, Thái Lan các đột biến P446L, N458Y, P574L và R561H thì rất phổ biến. Tại châu Phi, các đột biến K13 khá đa dạng nhưng lại hiếm khi xuất hiện như các đột biến có ý nghĩa, được báo cáo tại Cameroon, Trung Phi, Comoros, Congo, Gabon và allen phổ biến nhất được quan sát tại khu vực này làA578S1. Tuy nhiên, không phải tất cả các đột biến có ý nghĩa trên vùng cánh quạt K13 đều được báo cáo xác định sự nổi lên của kháng artemisinin. Những đột biến đại diện cho kiểu gen “passer-by”, chúng không dẫn đến sự chọn lọc kiểu gen đột biến K13. Thêm vào đó, vị trí của các đột biến ảnh hưởng đến kiểu hình làm sạch ký sinh trùng sốt rét. Xác định tính hợp lệ của đột biến K13 như là một chỉ thị phân tử kháng thuốc cần đòi hỏi mối tương quan với tình trạng chậm làm sạch ký sinh trùng sốt rét trong nghiên cứu lâm sàng, việc giảm độ nhạy cảm của thuốc trong thử nghiệm ex vivo hoặc in vitro (nghiên cứu RSA0-3h), hay giảm độ nhạy cảm trong thử nghiệm in vitro của các nghiên cứu quá trình tải nạp đột biến K13 vào mô hình động vật để nghiên cứu. Đa hình đột biến K13 và dấu hiệu kháng artemisinin trong lâm sàng Theo tác giả Fredric Ariey và cộng sự (2014), đa hình các điểm đột biến gen K13, nằm trên domain Kelch 13 propeller, còn được gọi là “vùng cánh quạt” của protein K13 đã được chứng minh có liên quan đến tỷ lệ sống còn của ký sinh trùng sốt rét trong thử nghiệm RSA0–3h, hiện tượng chậm làm sạch ký sinh trùng sốt rét hay giảm sự nhạy cảm của ký sinh trùng sốt rét với thuốc ở giai đoạn tư dưỡng và tỷ lệ ký sinh trùng sốt rét dương tính vào ngày thứ 3 (giờ thứ 72) ở bệnh nhân điều trị sốt rét do P. falciparum với ACTs, đồng thời cũng cho thấy mối tương quan chặt chẽ giữa sự hiện diện của alen đột biến, tỷ lệ ký sinh trùng sốt rét sống sót trong thử nghiệm ex vivo (Witkowski. B và cs., 2013)12 và tỷ lệ làm sạch ký sinh trùng sốt rét trong thử nghiệm in vivo. Có 17 allen đột biến trên protein K13 ở Campuchia đã được xác định. Trong đó, chỉ có một số alen đột biến có tần số cao (> 5%), có chứa đột biến đa hình SNPs, cụ thể là Y493H, R539T và C580Y nằm tương ứng ở vị trí cánh quạt 2, 3 và 4. Nghiên cứu này đã lập bản đồ các điểm đột biến xác định tỷ lệ ký sinh trùng sốt rét có chứa các đột biến có ý nghĩa và sự phân bố địa lý của chúng. 
Bên cạnh đó, sự phân bố tần số của alen đột biến tại một số tỉnh ở Campuchia cũng phù hợp với tỷ lệ tồn tại ký sinh trùng sốt rét ở ngày D3 ở bệnh nhân sau khi được điều trị bệnh sốt rét do chủng P. falciparum với thuốc phối hợp ACTs. Hiện tượng này được xem là chỉ điểm gợi ý cho kháng artemisinin trong điều trị lâm sàng. Ngoài ra, nghiên cứu của Ashley và cộng sự (2014) tại các nước Đông Nam Á và một số nước châu Phi như Nigeria, Congo, Kenya đã chỉ ra tình trạng chậm làm sạch ký sinh trùng sốt rét (thời gian làm sạch ½ ký sinh trùng sốt rét > 5 giờ), cũng liên quan chặt chẽ với các đột biến điểm trên K13-propeller. Trong nghiên cứu này, các đột biến cánh quạt K13 có 91,8% độ nhạy và độ đặc hiệu 88,4% với thời gian làm sạch 50% mật độ ký sinh trùng sốt rét > 5 giờ. Khoảng 25% số ca có mang các đột biến gen K13 va các đột biến K13 sau vị trí acid amin 440 có liên quan trực tiếp đến tình trạng chậm làm sạch ký sinh trùng sốt rét. Tuy nhiên, trong nghiên cứu này kháng thuốc artemisinin lây lan chủ yếu là tại các nước Đông Nam Á. Tại Việt Nam, nghiên cứu của Kamala Thriemer và cộng sự (2014)6 tại Quảng Nam, từ 2012-2013, xuất hiện các đột biến gen K13 tại vị trí 543 và 493, không tìm thấy đột biến tại vị trí 539 và 580. Mẫu phân lập mang đột biến tại vị trí 543 có thời gian làm sạch KSTSR cao hơn đáng kể so với mẫu mang đột biến dạng hoang dại (WT_wild-type). Độ nhạy, độ đặc hiệu của đột biến SNPs 543 với tình trạng chậm làm sạch ký sinh trùng sốt rét thể vô tính P. falciparum lần lượt là 91,4% và 27,1%. Với tỷ lệ tồn tại ký sinh trùng sốt rét ngày D3 gần 30%, điểm theo dõi sentinel của huyện Nam Trà My (Quảng Nam) cùng với điểm huyện Phú Thiện (Gia Lai) được TCYTTG đánh giá là khu vực đầu tiên của Việt Nam không có giao lưu biên giới nghi ngờ xuất hiện kháng thuốc artemisinin. Nghiên cứu từ 2007-2012 tại biên giới Trung Quốc và Myanmar của Wang và cộng sự (2015) cũng đã xác định được 17 đột biến gen K13 với 7 loại đột biến mới. Đột biến F446I chiếm ưu thế với 27,2%, C580Y xuất hiện với tần số thấp 1,6% và có sự gia tăng về tần số ký sinh trùng sốt rét mang gen đột biến theo từng năm. Tuy nhiên, điều tra này lại không tìm thấy các đột biến I543T, R539T và Y493H liên quan đến tình trạng chậm làm sạch ký sinh trùng sốt rét như ở Campuchia, kể cả M476I. Đi kèm là tỷ lệ tồn tại ký sinh trùng sốt rét ngày D3 tại khu vực này là > 10%, nên cần có những nghiên cứu tiếp theo về khả năng kháng artemisinin lan rộng sang các nước thuộc tiểu vùng Mê Kông. Sự nổi lên của đa hình đột biến K13 và sự lan rộng kháng artermisinin dường như là độc lập Theo nghiên cứu tiến hành tại Bangladesh, Abu Naser Mohon và cộng sự (2014) đã phát hiện thêm một đột biến tại vị trí A578S, đột biến này nằm gần vị trí với đột biến đã biết là C580Y ở Đông Nam Á. Đột biến này gây ra sự thay đổi cấu trúc không gian của protein bằng cách thay đổi bề mặt tương tác với protein khác dẫn đến biến đổi chức năng sinh học của protein, tác động đến các hoạt động của artermisinin, kết quả là thời gian làm sạch ký sinh trùng sốt rét bị kéo dài. 
Tuy nhiên, đột biến này không liên quan đến việc tăng thời gian làm sạch ½ số ký sinh trùng sốt rét (parasite clerance half-life) hay nói cách khác là không liên quan đến kháng artemisinin. Dẫn liệu đã chứng minh rằng đột biến liên quan chặt chẽ với kháng artemisinin là không có mặt ở Bangladesh. Nghiên cứu khác của Rie Isozumi và cộng sự (2015) tại Kenya, đã xác định được 4 loại đột biến có ý nghĩa và 5 đột biến “im lặng” ở vùng bảo tồn cao của gen K13 trên chủng P. falciparumvà các đột biến này có tính chất xuất hiện chưa rõ ràng. Tuy nhiên, những đột biến này không giống với công bố của Ariey và cộng sự (2014). Tác giả đã tìm ra đột biến A78S tại quần đảo Mangano. Tương tự như nghiên cứu của Abu Naser Mohon tại Bangladesh, tác giả cũng cho rằng đột biến này làm biến đổi acid amin từ dạng kỵ nước sang dang ưa nước, nằm gần vị trí với đột biến C580Y (được xác định tại Campuchia), tác động đến tương tác protein-protein, điều này làm ảnh hưởng đến tính nhạy của ký sinh trùng sốt rét với artemisinin. Một giám sát về sự lan rộng của kháng artemisinin, liên quan đến đột biến gen K13 của Kyaw M Tun và cộng sự (2015)7 tại Myanmar, đã xác định được 29 đột biến khác nhau tại vị trí sau acid amin 210, với 26 đột biến trong số đó nằm sau vị trí acid amin 440 (cho thấy hầu hết các đột biến này nằm tập trung tại vùng cánh quạt đầu tiên, từ acid amin 441-475) với 3 đột biến có tần số cao nhất lần lượt là C580Y, F446I và P574L và nhiều đột biến khác, phần lớn các đột biến này đã được xác định trong các nghiên cứu tại Campuchia và gần đây có ở Việt Nam, Myanmar, Thái Lan và Lào. Đặc biệt, sự có mặt của đột biến M476I do quá trình chọn lọc trong thời gian dài với áp lực thuốc artemisinin2. Đột biến C580Y được cho là liên quan đến tình trạng chậm làm sạch ký sinh trùng sốt rét có mặt ở khu vực biên giới của Myanmar-Thái Lan với tần số cao nhất, tiếp theo đó là F446I ở khu vực gần biên giới Ấn Độ. Ngoài ra, đột biến P574L, được cho là liên quan đến tình trạng chậm làm sạch ký sinh trùng sốt rét, hay ít nhất là có tác động tương đương với C580Y trong việc kéo dài thời gian làm sạch ký sinh trùng sốt rét xuất hiện với tần số cao. Trong khi sự phân bố khác nhau của các đột biến tại các vùng địa lý khác nhau chưa được làm rõ nhưng có thể giải thích rằng Myanmar đang ở giai đoạn đầu của quá trình tiến hóa (so với các điểm ở Campuchia) và có thể xem như một loại đột biến. Những đột biến ở Myanmar cho thấy sự giảm mức độ kháng artemisinin, có thể là do có sự chọn lọc đặc biệt từ việc sử dụng thuốc sốt rét, tính di truyền của vật chủ hoặc muỗi sinh học có thể dẫn đến sự phân bố khác nhau về các đột biến ở 2 vùng phía Nam và bắc Myanmar. Cần có những nghiên cứu sâu hơn về sự thích ứng của ký sinh trùng sốt rét và độ nhạy với thuốc sốt rét có thể giải đáp câu hỏi này. 
Nhằm xác định nguồn gốc của các đột biến K13 từ các vùng địa lý khác nhau, Takala Harrison và cộng sự (2015)13 đã tiến hành phân tích về haplotype cuả các đột biến K13. Kết quả cho thấy các đột biến K13 phổ biến nhất là 493H, 574L và 580Y. Hầu hêt các đột biến K là nổi lên một cách độc lập. Ngoại trừ kiểu 574L có hai nguồn gốc từ Việt Nam và Myanmar. Sự lan rộng của C580Y đã xuất hiện 2 lần. Một lần xuất hiện dường như có chung nguồn gốc Campuchia/ Việt Nam (tương tự như 493H) và lần thứ hai là tại Myanmar. Hai đột biến 580Y và 493H, phân phối tần số cho thấy nó có nguồn gốc từ Campuchia, nơi mà hai loại đột biến này là phổ biến nhất, sau đó lây lan đến Việt Nam (?). Nghiên cứu không tìm thấy bằng chứng về sự lây lan về phía Tây của kháng artemisinin từ Campuchia đến Myanmar. Ngoài ra, nghiên cứu cũng cho thấy các đột biến K13 nằm trên domain kháng (domain đầu tiên trên vùng cánh quạt) có liên quan đến việc kéo dài thời gian làm sạch ký sinh trùng sốt rét hơn so với các kiểu hoang dại (wild-type). Trong một nghiên cứu về chọn lọc và lan truyền các allen kháng artermisinin tại Thái Lan (2015), Các kiểu gen của KSTSR được xác định đột biến K13propeller liên quan kháng artemisinin, các tín hiệu chọn lọc dương nhằm tìm ra bằng chứng liệu các alen kháng artemisinins có đang gia tăng tại Thái Lan. Tổng số 7 alen đột biến K13 được tìm thấy (N458Y, R539T, E556D, P574L, R575K, C580Y và S621F). Đáng chú ý, loại đột biến R575K và S621F trước đây chưa được báo cáo tại Thái Lan. Đột biến phổ biến xác định kháng artemisinins là C580Y mang hai haplotype khác nhau tách biệt bởi vị trí địa lý, dọc theo biên giới Thái Lan-Campuchia và Thái Lan-Myanmar. Dường như hai haplotype này có thể có nguồn gốc tiến hóa hoàn toàn độc lập nhau. Các nghiên cứu khác của Ashley và cộng sự3, Takala Harrison14 và Miotto15 cũng chỉ ra đột biến C580Y là chiếm ưu thế tại Campuchia, Việt Nam và Myanmar. Các tác giả này cũng chứng minh allen C580Y dường như xuất hiện độc lập ở Campuchia và Myanmar. Nhìn chung, các ký sinh trùng sốt rét có đột biến K13 propeller có liên quan đến khángartemisinins hiện nay lan rộng dọc theo biên giới Thái Lan-Campuchia và Thái Lan-Myanmar trước khi thiết lập chương trình ngăn chặn kháng artemisinin ở trong vùng này. Tại đây, các đột biến gen kháng K13đã cho thấy xuất hiện khắp Thái Lan vào đầu năm 2007, trước tiên dọc theo biên giới Thái Lan-Campuchia và Thái Lan-Myanmar. 
Amed Ouattara và cộng sự đã tiến hành một nghiên cứu tại Mali, nơi mà kháng artemisinin dẫn đến tình trạng chậm làm sạch ký sinh trùng sốt rét là chưa được báo cáo, kết quả thu được một số đột biến gen K13 với tần số thấp. Tuy nhiên, các đột biến được cho là liên quan chặt chẽ đến tình trạng chậm làm sạch ký sinh trùng sốt rét tìm thấy tại các nước Đông Nam Á là không có mặt ở Mali (châu Phi). Các đột biến tìm thấy tại Mali nằm trên miền protein có liên quan đến việc kéo dài thời gian làm sạch ký sinh trùng sốt rét. Do vậy, nghiên cứu xác định không có mối tương quan giữa đột biến K13 và kháng artemisinin tại Mali, tương tự các nghiên cứu tại 14 quốc gia khác tại châu Phi (Taylor SM và cs., 2015)16. Nghiên cứu tại Senegal từ 2012-2013, chỉ phát hiện 2 đột biến gen K13 là T149S và K189T, không phát hiện các đột biến liên quan đến kháng artemisinin như đã được xác định tại Đông Nam Á (Torrentino-Madamet M và cs., 2014)17. Trong một nghiên cứu khác tại Uganda đánh giá sự liên quan giữa đột biến gen K13 và Falcipain-2 với tình trạng kháng artemisinin18, loại Falcipain-2 hay cysteine protease falcipain-2 (FP2; PF3D7_1115700) là một enzym protease thủy phân hemoglobine của hồng cầu vật chủ. Đột biến tại codon 69 dẫn đến gián đoạn gen Falcipain-2 có thể “khóa lại” quá trình thủy phân hemoglobin, dẫn đến các ký sinh trùng sốt rét tăng nhạy cảm với các chất ức chế protease và kết quả là làm giảm hoạt động của artemisinin19. Phân tích về mặt phân tử, ngoài sự có mặt một số đột biến không liên quan đến kháng artemisinin, không thấy có mặt các đột biến C580Y, R539T hay Y493H, là những đột biến liên quan chặt chẽ với tình trạng chậm làm sạch ký sinh trùng sốt rét tại các nước Đông Nam Á, kể cả đột biến M476I. Như vậy, sự hạn chế về đa hình các đột biến gen K13 và đa dạng trong cấu trúc gen Falcipain-2 không thay đổi trước và sau khi sử dụng ACTs một cách rộng rãi để điều trị sốt rét do P. falciparum cho thấy đột biến gen K13 không ảnh hưởng đến việc điều trị bằng thuốc phối hợp ACTs và thuốc ACTs vẫn là thuốc điều trị sốt rét P. falciparum hiệu quả tại quốc gia này (Melissa D. Conrad và cs., 2014)18. 
Nhìn chung, có rất nhiều đột biến K13 tồn tại, song không phải luôn luôn tỷ lệ thuận với sự làm sạch chậm ký sinh trùng sốt rét sau điều trị bằng thuốc ACTs. Sự có mặt của marker kháng thuốc artemisinin và lan rộng, dường như độc lập với nhau. Do đó, cần thiết phải hiểu và làm rõ vai trò tính đa hình đột biến K13 trong vấn đề kháng artemisinin để giám sát kháng thích hợp và tin cậy(Elizabeth A.W. và cs., 2014)20. Các nghiên cứu này cho thấy có giá trị thực sự về giám sát phân tử, cần thực hiện song hành với giám sát dịch tễ. Sự lây lan toàn cầu của kháng chloroquin dẫn đến tử vong hàng triệu sinh mạng ở châu Phi và rõ ràng, Myanmar là một nơi có chứa ký sinh trùng sốt rét kháng artemisinins. Những dữ liệu này nhấn mạnh mối quan tâm là kháng artemisinins có thể theo những con đường của sự lây lan trong lịch sử của kháng thuốc chống sốt rét từ Đông Nam Á, qua Myanmar, qua Ấn Độ đến châu Phi. Hơn nữa, sự gia tăng đáng kể dân di cư và du lịch quốc tế có thể trực tiếp thúc đẩy sự lây lan của kháng artemisinin. Kháng thuốc artemisinin có thể đảo ngược xu hướng giảm tỷ lệ mắc và tử vong do sốt rét gần đây. Hiểu biết về đột biến propeller K13 cung cấp toàn cảnh các mức độ kháng thuốc artemisinin, nhưng không cung cấp thông tin trực tiếp về hiệu quả của thuốc phối hợp ACTs . Trong các khu vực nơi ký sinh trùng sốt rét đột biến K13 đang thịnh hành, dự báo về hiệu quả của thuốc điều trị và dự báo kháng vẫn gặp nhiều khó khăn. Một số hướng nghiên cứu mới về chỉ điểm phân tử của kháng artemisinin Tương tự như kháng thuốc của virus và vi khuẩn,P. falciparum đột biến cho phép ký sinh trùng sống sót ở liều điều trị của artemisinin. Các thay đổi về mặt phân tử phản ánh một sự thay đổi về mặt di truyền tiến hóa phức tạp và lâu dài, nhưng một khi kháng xảy ra vững bền các thay đổi về mặt di truyền sẽ tập hợp lại dưới điều kiện chọn lọc thuốc, các kiểu gen có thể trở nên cố định và các tác nhân kháng sẽ lan rộng nhanh chóng. 
Các nhà nghiên cứu sốt rét sử dụng các nghiên cứu liên quan đến bộ gen mở rộng (genome-wide association studies_GWAS) để tìm các đột biến liên quan đến Plasmodium kháng với artemisinin. Cuối năm 2014, các nhà di truyền học xác định hơn 30 loại đột biến trên vùng “propeller” mã hóa cho PfKelch13, protein nhận diện ở động vật có vú đối với enzyme E3 ubiquitin ligase, đóng vai trò quan trọng trong kháng artemisinin. Đa hình các đột biến K13 là sự thay đổi một amino acid trong vùng propeller của gen. Các đột biến K13 được xác định ở tần số thấp (< 5%) trên hầu hết các nơi ở châu Phi được kiểm tra; có 25 alen đột biến K13 được xác định, thì có 21 đột biến là mới và 04 đột biến khác đã xác định trước đây ở Đông Nam Á. Khi các ký sinh trùng sốt rét nhạy với artemisinins được kiến tạo để trình diện một alen đột biến K13 thường gặp tại Campuchia, chúng sẽ được bảo vệ chống lại sự phơi nhiễm artemisinin trong phòng thí nghiệm; thử nghiệm các alen châu Phi trong hệ thống này có thể là bước đầu tiên trong việc xác định tầm quan trọng của các allen mới này của ký sinh trùng sốt rét đáp ứng với artemisinin. Ngoài ra, Mbenque và cộng sự21 còn tìm thấy các đột biến K13 gây ra kháng artemisinins thông qua sự gia tăng sự ổn định của enzyme bên trong ký sinh trùng, nó sẽ sản xuất các lipid phát tín hiệu phosphatidylinositol-3-phosphate (PI3P). PI3P là một lipid quan trọng để xuất các protein điều hòa độc lực ký sinh trùng sốt rét nội bào vào trong hồng cầu. Khi dùng DHA để tiêu diệt P. falciparum nhiễm trong hồng cầu người, cơ chế chủ động của artemisinin sẽ ức chế enzymeP.falciparum phosphatidylinositol 3-kinase (PfPI3K), enzyme sản xuất PI3P. Sự có mặt phong phú của PfPI3K và PI3P tăng đối với các chủng P.falciparum mang alle đột biến như C580Y và ngược lại, giảm đối với chủng wild-type. Trong khi artemisinin có các đích khác trong giai đoạn ký sinh trùng sốt rét muộn, thì PfPl3K là đích đầu tiên được xác định trong thể nhẫn sớm khi Plasmodium sp. ở trong hồng cầu. Đột biến gen mới gây kháng artemisinin Theo một nghiên cứu mới được công bố từ các nhà nghiên cứu của Trường Đại học y khoa nhiệt đới Luân Đôn Anh, cho biết các dấu hiệu ký sinh trùng sốt rét phát hiện ở châu Phi biểu hiện kháng các loại thuốc hiệu lực cao nhất đã được xác nhận với các bằng chứng trên in vivo và sinh học phân tử. Các nhà nghiên cứu ở đây tìm thấy ký sinh trùng sốt rét P. falciparum với đột biến gene ap2mu giảm độ nhạy với các loại thuốc chống sốt rét artemisinins. Một nghiên cứu vào năm 2013, cũng do trường thực hiện, đưa ra giả thuyết ban đầu về mối liên quan giữa đột biến ở gen ap2mu và mật độ của ký sinh trùng sốt rét còn lại trong máu của trẻ em ở Kenya sau khi đã được điều trị. 
Tuy nhiên, cần nghiên cứu thêm để khẳng định đây là các gen đặc hiệu cho kháng thuốc hay không vì trên thực tế có đột biến nhưng không kháng thuốc. Trong nghiên cứu mới, các nhà khoa học đã tiến hành biến đổi gen của ký sinh trùng sốt rét trong phòng thí nghiệm để làm đột biến ap2mu tương tự như quan sát ở Kenya. Các nhà khoa học phát hiện ký sinh trùng bị biến đổi đã làm giảm nhạy đáng kể đối với thuốc, phải tăng hơn 32% lượng thuốc artemisinins, thì khi đó ký sinh trùng đó mới bị tiêu diệt. Các ký sinh trùng sốt rét biến đổi gen cũng giảm nhạy 42,4% với loại thuốc sốt rét cổ điển như quinin. Đầu năm 2014, một nhóm nghiên cứu khác đã phát hiện đột biến ở gene K13 có liên quan đến tính kháng thuốc phối hợp có thành phần artemisinins ở Đông Nam Á. Thông thường, kháng thuốc sốt rét xuất phát từ một số nơi trong khu vực Đông Nam Á và sau đó lan rộng sang châu Phi. Nhưng những phát hiện mới cho thấy kháng thuốc có thể xuất phát một cách độc lập từ châu Phi. Cần tiến hành nghiên cứu trong phòng thí nghiệm và cả ở thực địa để có đánh giá chính xác về đột biến ở gene ap2mu, hy vọng những phát hiện này sẽ giúp hiểu biết rõ hơn về sốt rét kháng thuốc và là một công cụ quan trọng cho theo dõi hiệu quả điều trị sốt rét trong tương lai. 
Phát hiện của Roberto Amato15 cho thấy rằng những đột biến cơ bản đã xuất hiện với tác động ở mức hạn chế kháng artemisinin - cho đến khi đột biến xảy ra trong gen Kelch13. Nó tương tự như những gì xảy ra với các tế bào tiền ung thư, tích lũy những biến đổi di truyền nhưng chỉ trở thành ác tính khi xuất hiện đột biến quan trọng mang tính chất điều khiển, khởi động sự phát triển của các tế bào ung thư. Sự đa dạng của đột biến gen Kelch13 liên quan đến kháng artemisinin, với các biến thể mới liên tục nổi lên, dẫn đến khó khăn trong việc chỉ sử dụng một mình gen này như là một dấu ấn phân tử trong giám sát di truyền về kháng thuốc. Để giám sát các quần thể ký sinh trùng để có một nền tảng dữ liệu di truyền đặc hiệu - trong trường hợp này, một tập hợp gồm bốn đột biến đã được xác định rõ là genfd,arps10, mdr2 và crt- có thể cho phép các nhà nghiên cứu đánh giá khả năng đột biến kháng thuốc mới đang nổi lên ở các khu vực khác nhau, nhằm hỗ trợ xác định các khu vực có nguy cơ cao, ngay cả trước khi ký sinh trùng kháng xuất hiện.Các nhà nghiên cứu cũng đã phát hiện ra những manh mối mới về cách mà kháng artemisinin đã phát triển ở Đông Nam Á. Bằng cách so sánh ký sinh trùng từ Campuchia, Việt Nam, Lào, Thái Lan, Myanmar và Bangladesh, các nhà khoa học phát hiện ra rằng sự phân bố khác nhau của các đột biến Kelch13 được khoanh vùng trong các khu vực địa lý tương đối rõ ràng. 
Ký sinh trùng sốt rét kháng artemisinin xuất hiện bằng cách di chuyển qua biên giới các quốc gia, điều này chỉ xảy ra trên quy mô hạn chế và trong thực tế, đột biến Kelch13 phổ biến rộng rãi nhất là loại C580Y, dường như đã xuất hiện một cách độc lập trong nhiều khu vực. Đáng chú ý là ký sinh trùng sốt rét dọc theo biên giới Thái Lan-Myanmar dường như xuất hiện đột biến một cách riêng biệt so với những người đột biến xuất hiện ở Campuchia và Việt Nam. Điều quan trọng, quần thể ký sinh trùng trong cả hai khu vực có chung những đột biến di truyền cơ bản, mặc dù chúng cách ly về mặt di truyền một cách rõ ràng. Một số đột biến có thể không ảnh hưởng trực tiếp đến kháng thuốc, mà là cung cấp một môi trường để các đột biến kháng thuốc được dung nạp tốt. Kể từ khiKelch13 biến đổi đáng kể sau 50 triệu năm tiến hóa của loài Plasmodiumsp., có thể đặt giả thiết rằng gen này là cần thiết đối với khả sống sót của ký sinh trùng sốt rét. Do đó, đột biến Kelch13có thể tạo ra các đột biến bất lợi nghiêm trọng, ảnh hưởng đến sự tồn tại của ký sinh trùng sốt rét, trừ một số thay đổi khác có thể chống lại tác động tiêu cực này. Hiện nay, kháng artemisinin dường như chỉ giới hạn ở khu vực Đông Nam Á, nhưng tình hình có thể thay đổi khi quần thể ký sinh trùng tiếp tục phát triển. Bằng cách kết nối dữ liệu di truyền với các dữ liệu lâm sàng, các nhà khoa học đang phát triển một sự hiểu biết rõ ràng về các yếu tố di truyền liên quan đến sự xuất hiện của kháng thuốc, và từ đó bắt đầu cung cấp những đầu mối quan trọng làm thế nào để ngăn chặn sự lây lan của kháng thuốc. Bên cạnh đó việc xác định liệu kháng artemisinin gây ra sự lây lan hay là độc lập với sự nổi lên do sốt rét tại khu vực biên giới Campuchia-Thái Lan là điều hết sức cần thiết. Nếu vấn đề kháng thuốc tồn tại ở một khu vực nhỏ, nó có thể được kiểm soát và loại trừ, ngược lại kháng thuốc có thể lây lan sang các nước lân cận như Việt Nam, Lào, Myanmar khi đó sẽ là thảm họa phức tạp. Một số câu hỏi đặt ra? -Hiện tại kháng thuốc thật sự đã xảy ra chưa hay chỉ là “giảm dung nạp thuốc” vì với các chỉ điểm phân tử cũng như tiêu chí đánh giá kháng thuốc vẫn còn thay đổi theo thời gian như chúng ta đang thấy từ năm 2009-2015; -Nếu đánh giá có sự liên quan giữa sự chậm làm sạch ký sinh trùng sốt rét sau 3 ngày điều trị bằng thuốc ACTs với các đột biến thì những ca còn tồn tại ký sinh trùng sốt rét thể vô tính ngày D3nhưng không có đột biến hoặc ngược lại thì giải thích như thế nào cho phù hợp? -Nếu có thể, tại sao chúng ta không đánh giá mối liên quan giữa chậm làm sạch ký sinh trùng sốt rét thể vô tính với thời gian làm sạch 50% số ký sinh trùng sốt rét (t1/2 parasite clearance time) với các đột biến phân tích được? -Với các kỹ thuật phân tích hiện có liệu có đủ cho kết quả khẳng định và làm cơ sở cho sàng lọc kháng thuốc hàng loạt tại nhiều vùng khác nhau hay không? Điều này có thể giúp cho kết quả nhanh nhưng không thể xem đó là chuẩn vàng vì có một số vấn đề bất hợp lý? -Hiện vẫn còn rất ít các ấn bản đánh giá lĩnh vực dược động học liên quan đến kháng thuốc cảP. falciparumvàP. vivax tại nhiều vùng kháng thuốc. Tại Việt Nam, vẫn còn thiếu những nghiên cứu thuyết phục về kháng thuốc, cần bổ sung; -Các phương diện giữa lý thuyết đến thực hành đôi khi nhận được kết quả khác trái ngược nhau. Do đó, cần có các tiêu chí và điểm bổ sung trong định nghĩa kháng thuốc; -Đến nay, vẫn chưa thể phân tích tổng thể đầy đủ các yếu tố góp phần vào một trường hợp kháng thuốc (vì nó có thể liên quan đến con người, muỗi, ký sinh trùng, tình trạng dung nạp và miễn dịch, đột biến phân tử liên đới,...); --Kháng thuốc hiện nay không những có xuất hiện tại các vùng biên giới quốc tế giữa các quốc gia mà còn xuất hiện các vùng mà người dân hoàn toàn không hề có giao lưu như điểm nghiên cứu ở Nam Trà My ở Quảng Nam và điểm Phú Thiện ở Gia Lai. Đây là điểm đáng lưu ý trong nghiên cứu tiếp theo đánh giá tổng thể về kháng thuốc. Tài liệu tham khảo 1. World Health Organization. Status report on artemisinin and ACTs resistance September 2015. 2015;(September):1-8. 2. Ariey F, Witkowski B, Amaratunga C, et al. A molecular marker of artemisinin-resistant Plasmodium falciparum malaria. Nature. 2014;505(7481):50-55. 3. Ashley EA, Dhorda M, Fairhurst RM, et al. Spread of Artemisinin Resistance in Plasmodium falciparum Malaria. N Engl J Med. 2014;371(5):411-423. 4. Phyo AP, Nkhoma S, Stepniewska K, et al. Emergence of artemisinin-resistant malaria on the western border of Thailand: a longitudinal study. Lancet. 2012;379(9830):1960-1966. 5. Na-Bangchang K, Karbwang J. Emerging artemisinin resistance in the border areas of Thailand. Expert Rev Clin Pharmacol. 2013;6:307-322. 6. Thriemer K, Hong N, Rosanas-Urgell A, et al. Delayed Parasite Clearance after Treatment with Dihydroartemisinin-Piperaquine in Plasmodium falciparum Malaria Patients in Central Vietnam. Antimicrob Agents Chemother. 2014;58(12):7049-7055. 7. Tun KM, Imwong M, Lwin KM, et al. Spread of artemisinin-resistant Plasmodium falciparum in Myanmar: a cross-sectional survey of the K13 molecular marker. Lancet Infect Dis. 2015;15:21-26. doi:10.1016/S1473-3099(15)70032-0. 8. Wang Z, Shrestha S, Li X, et al. Prevalence of K13-propeller polymorphisms in Plasmodium falciparum from China-Myanmar border in 2007-2012. Malar J. 2015;14(1):168. doi:10.1186/s12936-015-0672-9. 9. Mohon AN, Alam MS, Bayih AG, et al. Mutations in Plasmodium falciparum K13 propeller gene from Bangladesh (2009-2013). Malar J. 2014;13(1):431. doi:10.1186/1475-2875-13-431. 10. World Health Organization. World Malaria Report 2015 -Regional Profiles.; 2015. 11. Kyaw MP, Nyunt MH, Chit K, et al. Reduced Susceptibility of Plasmodium falciparum to Artesunate in Southern Myanmar. PLoS one. 2013;8. 12. Witkowski B, Amaratunga C, Khim N, et al. Novel phenotypic assays for the detection of artemisinin-resistant Plasmodium falciparum malaria in Cambodia: in-vitro and ex-vivo drug-response studies. Lancet Infect Dis. 2013;13(12):1043-1049. 13. Takala-Harrison S, Jacob CG, Arze C, et al. Independent emergence of artemisinin resistance mutations among Plasmodium falciparum in Southeast Asia. J Infect Dis. 2015;211(5):670-679. doi:10.1093/infdis/jiu491. 14. Takala-Harrison S, Jacob CG, Arze C, et al. Independent emergence of artemisinin resistance mutations among Plasmodium falciparum in Southeast Asia. J Infect Dis. 2015;211(5):670-679. doi:10.1093/infdis/jiu491. 15. Miotto O, Amato R, Ashley EA, et al. Genetic architecture of artemisinin-resistant Plasmodium falciparum. Nat Genet. 2015;47(3):226-234. doi:10.1038/ng.3189. 16. Taylor SM, Parobek CM, De Conti DK, et al. Absence of putative artemisinin resistance mutations among Plasmodium falciparum in sub-Saharan Africa: A molecular epidemiologic study. J Infect Dis. 2015;211(5):680-688. doi:10.1093/infdis/jiu467. 17. Torrentino-Madamet M, Fall B, Benoit N, et al. Limited polymorphisms in k13 gene in Plasmodium falciparum isolates from Dakar , Senegal in 2012 – 2013. 2014;13(472):1-5. 18. Conrad MD, Bigira V, Kapisi J, et al. Polymorphisms in K13 and falcipain-2 associated with artemisinin resistance are not prevalent in Plasmodium falciparum isolated from Ugandan children. PLoS one. 2014;9(8):e105690. 19. Rosenthal PJ. Falcipains and other cysteine proteases of malaria parasites. Adv Exp Med Biol. 2011;712:30-48. doi:10.1007/978-1-4419-8414-2_3. 20. Winzeler EA, Manary MJ. Review: Drug resistance genomics of the antimalarial drug artemisinin. Genome Biol. 2014;15(11):544. 21. VanHook AM. Antimalarial drugs inhibit PI3P production. Sci Signal. 2015;8(375):118.
|

