|
Miễn dịch trong bệnh nhiễm trùng nói chung và ký sinh trùng nói riêng
Phương thức lẩn tránh miễn dịch của tác nhân gây bệnhnói chung và ký sinh trùng sốt rét nói riêng là các phương thức mà tác nhân gây bệnh sử dụng để chống lại cơ chế hoạt động của hệ miễn dịch (immunity system). Nếu như động vật có xương sống đã phát triển nhiều hàng rào miễn dịch khác nhau để chống lại các tác nhân gây bệnh (tác nhân lây nhiễm), thì các tác nhân gây bệnh cũng có nhiều phương thức phức tạp để lẩn tránh các hệ thống miễn dịch này. Nhiều tác nhân gây bệnh dùng một hay nhiều phương thức để thoát khỏi/ lẩn tránh hệ thống miễn dịch, chẳng hạn virus HIV đã thành công khi chiến thắng hệ thống đáp ứng miễn dịch. Về điều này, các tác nhân gây bệnh có thể “thiên biến vạn hóa” theo nhiều cách khác nhau: 1. Thay đổi kháng nguyênMột tác nhân lây nhiễm có thể lẩn tránh sự phá hủy của hệ miễn dịch là thay đổi kháng nguyên của nó. Đây là một nguyên nhân đặc biệt quan trọng, chống lại hàng rào các kháng thể trên bề mặt. Có ba phương thức biến đổi kháng nguyên là đa dạng biến thể, sử dụng kháng thể trung hòa, sắp xếp lại bộ gen. Đa dạng biến thểCác nhân tố lây nhiễm tồn tại ở các kiểu kháng nguyên đa dạng. Ví dụ, người ta biết tới 84 biến thể của phế cầu Streptococcus pneumoniae, một loài vi khuẩn nguy hiểm gây nên các bệnh nhiễm trùng như viêm phổi, viêm tai hay viêm màng não. Mỗi biến thể trong số chúng khác nhau về cấu trúc của lớp vỏ polysacaride của chúng. Các biến thể này được phân biệt nhờ các kỹ thuật kiểm tra huyết thanh và do vậy thường được gọi là type huyết thanh (kiểu huyết thanh - serotype). Khi cơ thể nhận được kiểu huyết thanh của chủng vi khuẩn đó thì nó sẽ có khả năng miễn dịch đặc hiệu với chính chủng vi khuẩn đó, chống lại sự tái xâm nhập trở lại của chủng vi khuẩn đó nhưng sẽ không có khả năng này nếu dùng loại huyết thanh khác. Do vậy, trong hệ thống miễn dịch, mỗi kiểu huyết thanh của chủng S.pneumoniae có mặt ở mỗi sinh vật. Về căn bản các tác nhân gây bệnh tương tự như nhau sẽ có thể gây nên bệnh nhiều lần ở những cá thể tương đối giống nhau. 
Sử dụng kháng thể trung hòaMột cơ chế tác động nữa của thay đổi kháng nguyên được nghiên cứu tới ở viruscúm. Vào một thời điểm nào đó, một kiểu virus cúm nào đó có thể là nguyên nhân của lây nhiễm cúm trên khắp nơi trên thế giới. Xã hội loài người đang dần dần tăng cường hệ thống miễn dịch bảo vệ đối với loại virus này, phần lớn các virus này sử dụng trực tiếp các kháng thể trung hoà do các gai – kháng nguyên bề mặt virus có tên là hemagglutinin (HA) và neuraminidase (NA). Nếu nó không có hai cách khác nhau này để thay đổi chính kiểu kháng nguyên của nó thì các virus sẽ đối mặt với hệ thống miễn dịch của vật chủ. Biến đổi kháng nguyênPhương thức thứ nhất trong hai phương thức này là biến đổi kháng nguyên (antigenic drift) được gây nên do các đột biến điểm ở vùng mã hoá cho gen hemagglutinin và protein bề mặt thứ hai là neuraminidase. Cứ 2-3 năm, thì các đột biến khác nhau tăng lên cho phép các virus tránh được sự trung hoà của các kháng thể trong quần thể; các đột biến khác ảnh hưởng đến các epitope được nhận ra bởi các tế bào T và đặc biệt là thụ thể tế vào T CD8, chính vì vậy các tế bào nhiễm các virus đột biến cũng tránh khỏi bị phá huỷ. Mỗi cá thể trước đó đã nhiễm bệnh do virus đó gây ra thì kể từ đó sẽ miễn dịch lại bệnh đó, biến thể cũ mẫn cảm với những biến thể mới. Những nguyên nhân của bệnh lan truyền tương đối khó xảy ra vì vẫn có một số phản ứng chéo với kháng thể và các tế bào T tạo thành để chống lại những virus biến đổi trước đó, nên hầu hết các quần thể có một mức độ miễn dịch nào đó. 
2. Chuyển đổi kháng nguyênCác dịch cúm lớn dẫn đến lan rộng khắp và thường không tránh được khi xảy ra quá trình thứ hai, cơ chế này có tên là chuyển đổi kháng nguyên. Điều này xảy ra khi mà có sự sắp xếp bộ gen ARN của virus cúm và các virus cùng họ với nó trong cơ thể động vật chủ, nhờ vậy làm cho có sự thay đổi của protein hemagglutinin trên bề mặt virus và dẫn tới kết quả là các virus khó có thể bị nhận ra, nếu tất cả các các biến đổi trước đó của virus đã bị các kháng thể và các tế bào T đã nhận ra. Do vậy, phần lớn con người đều mẫn cảm cao với các virus mới và kết quả là bị nhiễm bệnh. 3. Sắp xếp lại bộ genCơ chế thiết lập lại ADN của các tác nhân gây bệnh. Phần lớn các mẫu bệnh phẩm trùng mũi khoan ở châu Phi là đáng chú ý. Chúng thay đổi bề mặt kháng nguyên chủ yếu lặp đi lặp lại nhiều lần trong khi nhiễm vào tế bào vật chủ. Trùng mũi khoan là động vật nguyên sinh sinh sản trên sâu bọ, sản sinh ở khoảng không gian mô ngoại bào gây nên bệnh ngủ ở loài người. Trùng mũi khoan được bao phủ bởi một loại lớp glycoprotein, lớp glycoprotein biến đổi đặc biệt (VSG), nhờ vậy mà nó có thể nhận ra sự bảo vệ của kháng thể để nhanh chóng đáp lại nhằm xoá bỏ hầu hết các động vật ký sinh. Tuy nhiên, bộ gen của trùng mũi khoan chứa khoảng 1.000 gen VSG, mỗi loại trong số chúng có đặc tính kháng nguyên khác nhau. Để trốn thoát sự giám sát của hệ thống kháng thể hoạt động hiệu quả, không có cách nào khác là sắp xếp lại bộ gen, trùng mũi khoan đã phát triển chính hệ thống gen của mình bằng cách sắp xếp lại dẫn đến sự thay đổi sản phẩm biểu hiện của gen VSG. Một số ít trùng mũi khoan thay đổi lớp glycoprotein bề mặt để trốn sự tiêu diệt của kháng thể và chính nó làm các dịch bệnh phát triển trở lại. Các kháng thể tạo loại VSG mới, và cứ như vậy lặp lại chu trình. 
Chu trình xoá bỏ kháng nguyên vẫn tiếp tục làm cho hệ miễn dịch bị phá huỷ và bị tiêu diệt, dẫn tới phá huỷ hệ thống thần kinh, kết quả là cơ thể rơi vào trạng thái hôn mê. Bệnh này có tên là bệnh ngủ. Hoạt động lẩn trốn của trùng mũi khoan làm cho hệ thống miễn dịch thật khó khăn khi tiêu diệt nó và làm cho nó trở thành một bệnh nghiêm trọng ở châu Phi. Sốt rét cũng là một trong các bệnh gây bởi một loài động vật nguyên sinh ký sinh làm thay đổi kháng nguyên để giúp chúng có khả năng lẩn trốn hệ thống miễn dịch. Những thay đổi kháng nguyên cũng xảy ra ở vi khuẩn: sự sắp xếp lại ADN giúp cho sự thành công của hai vi khuẩn: Salmonella typhimurium, một nguyên nhân chính của bệnh nhiễm độc thức ăn do khuẩn salmonela, và vi khuẩn Nesseria gonorrhoeae gây ra bệnh lậu, một bệnh lây truyền qua đường tình dục và nó đang ngày càng trở thành một vấn đề nghiêm trọng ở Mỹ. S. typhumurium lần lượt thay đổi roi bề mặt bằng cách chuyển những đoạn ADN có chứa promoter vào gen biểu hiện ở roi. Để làm tắt sự biểu hiện của các gen này và cho phép làm biểu hiện gen thứ hai, mã hóa cho protein kháng nguyên khác. N. gonorrhoeae có một vài kiểu kháng nguyên, đặc biệt hầu hết là các protein pilin, nó giống như các loại glycoprotein bề mặt của trùng mũi khoan của châu Phi, được mã hóa bởi một vài gen và chỉ một trong số chúng được hoạt hóa vào bất kỳ thời gian nào. Các kiểu gen im lặng thỉnh thoảng thay thế cho các kiểu gen hoạt động theo hướng của promoter. Tất cả các cơ chế này giúp cho tác nhân gây bệnh lẩn trốn, nếu không thì bị hệ thống miễn dịch nhận ra. 
4. Sinh sảnCác virus thường đánh lạc hướng sự có mặt của chúng đối với hệ miễn dịch đồng thời khi xâm nhập vào tế bào vật chủ chúng tổng hợp protein của chính mình, các phân mảnh kháng nguyên được trình diện liên kết với các phân tử protein chuyên hóa nằm trên các tế bào bạch cầu, đặc biệt là các tế bào APC, các tế bào lympho B và T. Các phân tử protein này là sản phẩm của một tổng thể các gen mã hóa cho phức hệ tương thích mô chủ yếu (MGC_Major Histocompatibility Complex). Các phân tử này có vai trò cố định các mảnh peptit kháng nguyên được gọi là các phân tử của MHC. Khi nhân bản, một virus phải tạo ra protein của nó, và nhanh chóng tái bản dẫn tới phát bệnh và do đó không khó khăn để tế bào T phát hiện. Tuy nhiên, một số virus khi xâm nhiễm vào cơ thể dưới dạng âm ỷ là trường hợp các virus không hoạt hóa phiên mã. Trong trạng thái ‘âm ỷ’, những virus này không gây bệnh vì không có một chuỗi peptite nào được giải phóng để làm yếu đi khi chúng xuất hiện. Quá trình nhiễm tiềm tàng này sau này có thể được tái hoạt động và khiến cho mắc bệnh trở lại. 
Virus Herpes sp. là một virus hoạt động theo cơ chế ngấm ngầm này. Virus Herpes simplex (HSV), là nguyên nhân của bệnh đau nhức, nhiễm bệnh ở tế bào biểu mô và lan rộng vào các tế bào thần kinh cảm giác, lan nhanh khi bị nhiễm. Sau khi hệ miễn dịch đáp ứng miễn dịch có hiệu quả với khu biểu mô, các virus vẫn tồn tại dai dẳng ở trạng thái âm ỷ ở khu vực thần kinh cảm giác. Các nhân tố như ánh nắng mặt trời, sự nhiễm khuẩn, hay sự thay đổi các phản ứng hormone của virus, có sự truyền dọc theo xung thần kinh dẫn tới tái phát bệnh. Trong lúc này, thì đáp ứng miễn dịch trở nên hoạt động và điều hòa trở lại các vùng bị nhiễm bằng cách giết chết các tế bào biểu mô, tạo ra các vị trí đau mới. Chu kỳ này được lặp lại liên tục trong nhiều lần. Có hai lý do tại sao hệ thần kinh cảm giác vẫn mắc bệnh: đầu tiên là các virus "im lặng" trong hệ thần kinh và do vậy chỉ một số hay không có protein virus nào được sản sinh, qua đó tạo số ít các chuỗi peptit của virus trình diện MCH lớp I; thứ hai là, hệ thần kinh mang ít phân tử MHC lớp I, chính điều này làm cho việc các tế bào CD8 T khó khăn khi nhận ra các tế bào nhiễm bệnh và tấn công chúng. Biểu hiện mức độ MHC lớp I thấp có thể là có ích, vì chúng làm giảm mức độ ảnh hưởng tới hệ thần kinh, vì ta biết các tế bào thần kinh thì không có khả năng tái tạo, thật nguy hiểm khi nó sẽ bị tấn công bởi tế bào T-CD8 và nó cũng làm cho hệ thần kinh thường xuyên bị tổn thương khi bệnh mãn tính. Giống như virus Herpes sp. qua đường dây thần kinh, bệnh thủy đậu và bệnh zona, gây nên bệnh thủy đậu ở gà, nó vẫn im lặng ở một hay một số ít ở hạch thần kinh ở lưng sau đó là bệnh lan đi khắp cơ thể. Bệnh thủy đậu và bệnh zona, là hai bệnh biểu hiện lâm sàng khác nhau cùng một tác nhân gây bệnh là virus Varicella-zoster. Bệnh thủy đậu thường xuất hiện ở trẻ em, rất dễ lây và có thể lan thành dịch, trong khi đó bệnh zona thường mắc lẻ tẻ ở người lớn và những người bị tổn thương miễn dịch và không thấy gây thành dịch. Đa số bệnh nhân mắc bệnh không phải do tiếp xúc với người đã bị nhiễm bệnh mà là do sự tái hoạt hóa của virus tiềm ẩn. 
Sau khi nhiễm lần đầu Varicella-zoster di chuyển đến thần kinh tủy sống và tiềm ẩn trong hệ thần kinh tủy sống. Sau khi tái hoạt hóa (thường là nhiều năm), virus di chuyển đến da để gây ban. Biểu hiện đặc trưng của bệnh zona là viêm dây thần kinh, thường là dây cột sống hoặc một dây thần kinh nào đó, nổi mụn nước dọc theo dây thần kinh bị viêm (thường gặp nhất là ở vùng dây cột sống). Bệnh bắt đầu bằng phản ứng sốt, mệt mỏi, khó chịu, ban đỏ rát sần phát triển nhanh chóng hình thành nang tạo mụn nước, sau đó tạo thành mụn mủ nếu bị nhiễm khuẩn. Biến chứng nguy hiểm nhất của bệnh zona là đau do viêm dây thần kinh sau nhiễm. Cũng như bệnh thủy đậu, bệnh zona ở bệnh nhân rối loạn miễn dịch sẽ nặng hơn so với người bình thường. Song những người khi còn nhỏ đã bị bệnh thì sẽ được miễn dịch trong thời gian rất lâu. Khi cơ thể stress, suy nhược thần kinh, lo lắng, trong thời gian chữa bệnh, phụ nữ trong thời kỳ kinh nguyệt hay khi hệ miễn dịch hoạt động yếu thì có thể tái phát bệnh, bệnh sẽ lan xuống theo hệ thần kinh và biểu hiện ở khắp da. Quá trình tái phát bệnh này cũng giống như lần phát bệnh trước đó, các vùng da như thủy đậu lan rộng trên bề mặt da. Virus Epstein-Barr mang tên hai nhà khoa học lần đầu tiên quan sát thấy chúng dưới kính hiển vi điện tử trong lúc nuôi cấy nguyên bào lympho từ u lympho Burkitt (năm 1960). EBV là một virus phân bố khắp nơi trên thế giới. Chúng được đặc biệt quan tâm vì liên quan đến ung thư ở người như u lympho dạng Burkit, ung thư mũi - hầu. Virus Epstein-Barr cũng như virus herpes khác, gây nên bệnh tăng bạch cầu đơn nhân, một bệnh do gây nhiễm dòng tế bào lympho B. EBV gây nhiễm bào dòng tế bào lympho B bằng cách liên kết với CR2 (CD21), một thành phần của tế bào B, phức hệ đồng cảm thụ CD19. 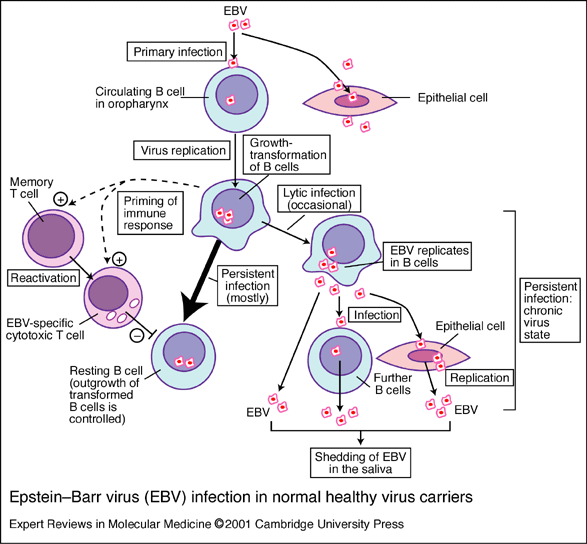
Khi lây nhiễm thì hầu hết các tế bào bị nhiễm bệnh và sản sinh ra các virus, cùng với nó là sản sinh nhanh chóng các tế bào lympho T đáp ứng đặc hiệu với kháng nguyên và tăng quá mức các bạch cầu đơn nhân trong máu chính vì vậy nó có tên là bệnh tăng bạch cầu đơn nhân. Sự lây nhiễm được điều khiển bởi tế bào CD8 T, nó giết sự sản sinh các tế bào B. Các phần nhỏ của dòng tế bào lympho B trở nên tiềm ẩn, tuy nhiên, EBV vẫn còn tồn tại nhưng không biểu hiện ở các tế bào này. Trong các tế bào bị nhiễm, hiếm khi tạo được tế bào trưởng thành, đa số các tế bào chuyển đổi(chuyển tiền tế bào B và tế bào B chín thành dòng nguyên bào lynpho có khả năng phát triển trong môi trường nuôi cấy nhân tạo) vẫn duy trì bộ gen virus ở dạng tiềm ẩn. Bộ gen này biểu hiện có giới hạn phức hợp kháng nguyên nhân (Epstein-Barr nuclear antigen_EBNA) từ EBNA1 đến EBNA6 và biểu hiện protein màng dạng tiềm ẩn (latent membrance protein_LMP), gồm có LMP1 và LMP2. Dựa vào sự biểu hiện của EBNA (thông qua sự biểu hiện của kiểu hình) mà biết được tế bào đã biến đổi hay chưa. EBNA1 cần thiết để duy trì bộ gen virus, nhưng EBNA1 lại ảnh hưởng tới protein để ngăn ngừa bản thân các peptit của chúng có thể bị các đáp ứng tế bào T trình diện. Các tế bào B gây nhiễm tiềm tàng có thể được phát hiện ra ở những cá thể khi cá thể đó có biểu hiện xóa bỏ sự nhiễm EBV và nơi chúng tồn tại trong môi trường nuôi cấy mô: sự vắng mặt dòng tế bào T, các tế bào nhiễm tiềm ẩn vẫn giữ lại bộ gen của EBV truyền cho các thế hệ tế bào tiếp theo. Nói một cách dễ hiểu là để chẩn đoán được bệnh ta phát hiện ra một số lượng lớn bạch cầu đơn nhân xuất hiện trong máu. Để tránh nhầm lẫn với các bệnh do các tác nhân khác (Cytomegalovirrus, Adenovirus) cần xác định ADN của virus EB. Trong cơ thể sống thì các tế bào B khi bị nhiễm virus EBV thường trải qua quá trình chuyển dạng ác tính, làm cho các dòng tế bào lympho B tăng lên được gọi là thể lympho Burkitt. Đây là một trường hợp hiếm gặp và nó dường như giống với quá trình mà sự kiểm soát của tế bào T bị vô hiệu hóa. Các bằng chứng sâu hơn nữa theo giả thuyết này xuất phát từ các bệnh nhân khi tăng lượng EBV liên kết với các dòng tế bào lympho B đòi hỏi và di truyền thiếu các tế bào T ở các thế hệ sau. Các bằng chứng gần đây cho thấy EBV cũng đi vào các tế bào thần kinh và chuyển dạng thành các tế bào ác tính dẫn tới bệnh Hogdkin. Bệnh u lympho Burkitt là một loại u ác tính của hệ bạch huyết (tế bào B đơn dòng) virus EBV có liên quan đến việc hình thành khối u, xong mặc dù không phải là tất cả vì rằng các gen ung thư do sự chuyển đổi hoán vị, mà sự hoán vị các gen vẫn xảy ra khi có hay không có EBV (yếu tố sốt rét cũng thúc đẩy sự phát sinh ung thư). Vai trò của EBV trong việc hình thành ung thư là kích thích tế bào B phân chia, tạo ra một lượng lớn tế bào B chuyển dạng và do đó làm tăng khả năng sắp xếp lại nhiễm sắc thể. 
5. Chống lại sự phá hủy/sử dụng cơ chế phòng thủ của vật chủMột số tác nhân gây bệnh gây ra đáp ứng miễn dịch bình thường nhưng số khác thì chạy trốn bằng các cơ chế đặc biệt để chống lại hệ thống miễn dịch. Trong trường hợp này, một số vi khuẩn bình thường bị các đại thực bào thu nhận nhưng nó trốn tránh phương thức bị hủy diệt do thực bào. Thực vậy, chúng dùng các đại thực bào như vật chủ chính của nó. Vi khuẩn Mycobacterium tuberculosis là một ví dụ, nó bị đại thực bào bắt giữ nhưng lại ngăn ngừa sự dung nạp của thực bào có lysozym, qua đó bảo vệ bản thân chúng khỏi bị lysozyme tiêu hủy. Những vi sinh vật khác, ví dụ vi khuẩn Listeria monocytogenes, trốn thoát khỏi thực bào bên trong tế bào chất của đại thực bào, nơi chúng có nhiều, và sau đó chúng lan đi tế bào bên cạnh trong mô mà không có hiện tượng này trong môi trường nuôi cấy tế bào. Vì lý do đó, chúng chống lại sự tiêu diệt của kháng thể. Tuy nhiên, các tế bào nhiễm L. monocytogenes mẫn cảm với tế bào T. Động vật nguyên sinh ký sinh Toxoplasma gondii biểu hiện lâm sàng cho thấy da rộp phồng lên và mọng nước, được phân tách từ các tế bào chết bởi vì nó không bị tiêu hóa trong dịch bào. Điều đó đích thực cho phép T. gonodii tránh cho các protein của nó bị phân hủy thành các mảnh peptit được thực hiện do các phân tử MHC và do vậy giúp chúng ẩn nấp khỏi hệ thống miễn dịch. Khi xoắn khuẩn xâm nhập gây nên hai bệnh, bệnh Lyme và bệnh giang mai, cách thức mà vi khuẩn này lẩn tránh vẫn có những hiểu biết hạn chế, và dẫn tới một bệnh dai dẳng và vô cùng nguy hiểm tồn tại trong mô. Bệnh Lyme xuất phát từ xoắn khuẩn có tên là Borrelia burgdorferi, trong khi đó bệnh giang mai là do vi khuẩn Treponema pallidum gây nên. Bệnh giang mai càng ngày càng lan rộng và phải có các hiểu biết chính xác và sâu rộng về sự nguy hiểm của hai bệnh này, và vi khuẩn được coi là tránh được sự nhận dạng của kháng thể do bề mặt của chúng được bao phủ bằng chính các phân tử vật chủ cho đến khi chúng đã lan tỏa khắp mô trên cơ thể, nơi nó ít bị tóm nhất bởi kháng thể. B. Đáp ứng miễn dịch1. Tạo ra sự phát sinh tác nhân gây bệnhPhổ biến nhiều nhân tố gây bệnh chặn đáp ứng miễn dịch. Ví dụ, tụ cầu khuẩn tiết chất độc như Staphylococcal enterotoxins (Ses_Nội độc tố của staphylococcus sp.) và Hội chứng sốc nhiễm độc, hoạt động như siêu kháng nguyên (superantigens). Siêu kháng nguyên như những protein liên kết với thụ thể kháng nguyên của số lượng lớn các tế bào T, qua đó kích thích chúng sản sinh ra cytokin là nguyên nhân của sự chặn đáp ứng miễn dịch. Chi tiết của quá trình này cho đến nay vẫn chưa được biết đến. Kích thích tế bào T sản sinh nhanh chóng và sau đó mau chóng trải qua quá trình chết theo chu trình, cùng nhau kiểm soát hệ miễn dich nhờ xóa bỏ nhiều tế bào T. 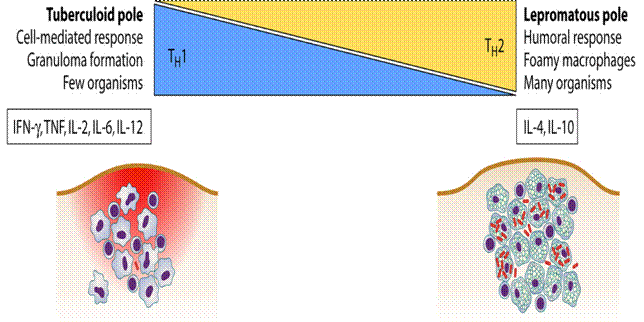
Nhiều tác nhân gây bệnh khác gây nên kìm hãm miễn dịch ôn hòa hay độc tố trong quá trình nhiễm bệnh cấp tính. Những dạng này thuộc dạng kìm hãm hoạt động miễn dịch chưa được biết đến nhưng lại rất quan trọng, vì chúng thường làm cho vật chủ bị tổn thương khi bị nhiễm lần hai. Một ví dụ trong đáp ứng miễn dịch là sưng, viêm, sốt. Những bệnh nhân sốt có khả năng làm giảm khả năng chống bệnh, các bệnh nhân này sẽ tử vong. Lý do tại sao vẫn chưa biết đầy đủ. Hầu hết các trường hợp chống lại hệ thống miễn dịch do nhiễm virus HIV. Nguyên nhân cơ bản dẫn đến tử vong của bệnh AIDS thường là nhiễm tác nhân gây bệnh cơ hội, một thuật ngữ dùng để mô tả một vi sinh vật có mặt trong môi trường nhưng lại không gây bệnh vì nó được điều chỉnh tuyệt vời với đáp ứng miễn dịch. Khi nhiễm HIV thì cơ thể ngày càng mất dần khả năng miễn dịch, cho phép bất kỳ vi sinh vật nào cũng có thể xâm nhập. Bệnh phong là một trường hợp bệnh lý phức tạp, bệnh do vi khuẩn Mycobacterium leprae, có thể chống lại hệ miễn dịch của con người cũng như miễn dịch trung gian giữa các tế bào, có hai dạng phong khác nhau là “leupromatous” và “tuberculoid”. Ở dạng phong lepromatous, biểu hiện khả năng nhân lên rất cao của vi khuẩn gây bệnh và sản xuất rất nhiều kháng thể mà không gây đáp ứng miễn dịch qua trung gian tế bào. Dạng thứ hai là phong tuberculoid trong đó bệnh nhân hầu như không có kháng thể hoặc rất ít kháng thể ở những mô tổn thương và có biểu hiện mạnh tính miễn dịch qua trung gian tế bào. 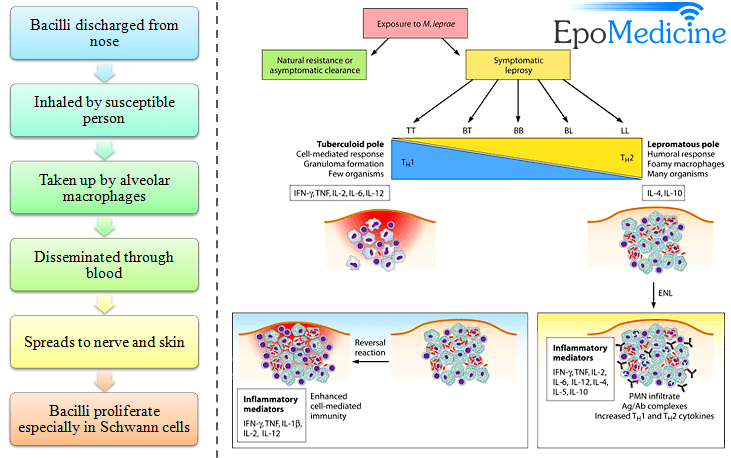
Một số ít vi khuẩn tìm thấy trong mô, các bệnh nhân thường sống sót, và hầu hết triệu chứng và bệnh lý do viêm nhiễm đáp ứng lại các vi sinh vật dai dẳng này. Sự khác nhau giữa hai dạng bệnh phong này là tỷ lệ giữa các tế bào Th1 và Th2. Chính vì điều này khiến người ta nghĩ tới có thể do sự khác biệt của các cytokine được sản sinh bởi tê bào T CD8, sẽ được nghiên cứu sâu vào các chương sau. 2. Góp phần vào sinh bệnh họcPhong Tuberculoid chỉ là một ví dụ của một bệnh mà nhân tố gây bệnh gây nên đáp ứng miễn dịch trên quy mô lớn. Khi mắc bệnh, cơ thể tăng nhiệt độ, ví dụ khi triệu chứng sốt đi kèm với nhiễm vi khuẩn do đại thực bào giải phóng cytokin. Điển hình là ví dụ về bệnh thở khò khè do sự xâm nhập của virus hợp bào hô hấp viết tắt là RSV (respiratory syncytial virus) là tác nhân chính gây bệnh đường hô hấp dưới ở trẻ nhỏ như viêm tiểu phế quản và viêm phổi. Các tế bào nhiễm virus có thể dung hợp với nhau để tạo thể hợp bào. Ở vùng khí hậu ôn đới, bệnh xảy ra vào mùa đông và đầu mùa xuân, còn các vùng nhiệt đới thì xảy ra vào đầu mùa mưa. Chỉ có 1 típ huyết thanh, nhưng có vài biến đổi về chủng. Bệnh về đường hô hấp do virus RSV là nguyên nhân gây bệnh chính của trẻ em ở khu vực phía tây, theo thống kê riêng Mỹ trong 90.000 ca mắc bệnh thì có tới 4.500 ca tử vong. Nhận thấy đầu tiên là đáp ứng miễn dịch với virus này đóng một vai trò quan trọng trong của bệnh, các ca bệnh cho thấy những đứa trẻ đã tiêm vaccine có alumprecipat chống virus bệnh sẽ nặng hơn những đứa trẻ không có vacxin. Hay nói cách khác, vaccin bất hoạt chống virus đã làm tăng thêm tỷ lệ viêm tiểu khí quản và viêm phổi so với nhóm đối chứng. 
Nguyên nhân có thể là do một thành phần miễn dịch của bệnh ở những đứa trẻ vẫn còn kháng nguyên do mẹ truyền và hình thành phức hợp miễn dịch. Sự mẫn cảm có thể mang tính cơ học. Ở trẻ sơ sinh, lòng ống khí tiểu khí quản rất hẹp nên khi bị viêm sẽ gây bệnh nặng, còn trẻ lớn hơn tiểu khí quản rộng hơn nên không thấy hiện tượng này. Điều này xảy ra là do vacxin tạo ra kháng thể trung hòa, nhưng tiếp theo sản sinh tế bào Th2. Sau khi nhiễm bệnh, tế bào Th2 giải phóng các interleukine IL-3, IL-4 và IL-5, điều này gây nên bệnh, tăng tiết dịch nhày và tiết tế bào ái toan. Chuột nhiễm virus RSV và phát triển bệnh tương tự như con người. Một ví dụ khác trong đáp ứng miễn dịch là đáp ứng miễn dịch với trứng của sán máng. Schistosome của sán ký sinh trong trứng ở tĩnh mạch cửa gan. Một số trứng đi tới ruột và di chuyển theo phân, ra ngoài phát tán bệnh; nơi cư trú của sán khác là cuống phổi, nơi chúng tiết ra một protein đáp ứng miễn dịch tạo ra viêm sưng phù mạn tính, xơ hóa gan và thậm chí suy phổi. Quá trình này phản ánh hoạt động quá mức của tế bào Th2 và được điều chỉnh nhờ tế bào Th1, interferon–γ (IFN–γ), hoặc tế bào T CD8, có thể hoạt động sản xuất IFN–γ. Nguyên nhân gây bệnh của virus gây nên bệnh u tuyến vú ở chuột (MMTV), đáp ứng miễn dịch được đòi hỏi khi nhiễm virus theo chu kỳ. MMTV được truyền từ tuyến vú của mẹ sang cho con theo đường sữa. Virus xâm nhập vào dòng tế bào lympho B của vật chủ, nó tái bản ở đây để đi vào biểu mô vú tiếp tục vòng đời của mình. Tuy nhiên, vì là một retrovirus, nên MMTV chỉ có thể sản sinh khi tế bào phân chia. Virus đảm bảo rằng tế bào B bị tấn công sẽ sản sinh nhanh không giới hạn để trên bề mặt của chúng hình thành các siêu kháng nguyên được mã hóa bởi hệ gen của MMTV. Siêu kháng nguyên này cho phép tế bào B bỏ qua các kháng nguyên đặc hiệu và kích thích số lượng lớn tế bào T CD4 có vùng Vβ thụ thể của tế bào T, sản sinh nhanh chóng cytokin và cấu tử CD40, làm cho các tế bào B phân chia. Chuột có thể bảo vệ bản thân chống lại sự tấn công của virus bằng cách xóa bỏ các tế bào T mang vùng Vβ nhận ra vùng siêu kháng nguyên. 
Tế bào B và đại thực bào đáp ứng lại vi khuẩn Mycobacterium leprae có hai dạng phong. Nhiễm M. leprae, chủng màu đỏ có thể tạo ra hai loại bệnh. Tuberculoid leprosy (trái), sinh trưởng của sinh vật được điểu khiển tốt nhờ Th1 làm hoạt hóa thực bào. Tuberculoid chứa u hạt và bị sưng tấy cục bộ và gây nên đau đớn như thần kinh ngoại biên bị phá hủy và sự sinh trưởng của vi khuẩn không chịu ảnh hưởng của thực bào; ở giai đoạn muộn hơn thì dẫn đến phá hủy giữa liên kết giữa mô bị tổn thương và thần kinh ngoại biên. Một vài trạng thái trung gian giữa hai dạng này. Cytokin ở hai dạng này có hình dạng khác nhau đã chỉ ra khi phân tích mARN được tách từ những thể thông thường của ba bệnh nhân mắc bệnh Tuberculoid leprosy (phương pháp lai Northern, bảng thấp). Cytokin được sản sinh do tế bào Th2 (IL-4, IL-5 và IL-10) cho dạng lepromatous, trong khi đó cytokin sản sinh do các tế bào Th1 (IL-2, IFL-γ và TNF-β) cho dạng tuberculoid. Có một vài chủng khác trong số MMTV có siêu kháng nguyên liên kết với lại các vùng Vβ khác. Hầu hết chuột đều có hệ gen của MMTV khá ổn định hòa vào ADN của chúng. Những virus sao chép ngược (retrovirus) nội sinh này mất một vài gen cần thiết và không cho phép sản sinh virion những chúng vẫn còn các gen mã hóa cho các siêu kháng nguyên của chúng, được biểu hiện ở tế bào vật chủ. Vì những siêu kháng nguyên có thể bị tiêu diệt ở tuyến ức, do vật các tế bào T mang cùng Vβ cũng bị loại bỏ. Tại sao khi chuột mất một số gen trong bộ gen của nó lại là cần thiết? Mục đich là loại bỏ tế bào T có thể được kích thích để tạo nên các siêu kháng nguyên để ngăn chặn bệnh khi virus MMTV mã hóa cho các siêu kháng nguyên. Để kiểm tra điều này, thí nghiệm trên chuột chuyển gen MMTV, những con chuột biểu hiện siêu kháng nguyên MMTV và do đó tiêu diệt tế bào T mang vùng Vβ liên kết với chúng. Vì không có tế bào T nào mất có thể kích thích các siêu kháng nguyên mã hóa cho các chủng MMTV, các tế bào B nhiễm virus có thể không được hoạt động trong những chuột chuyển gen này. Do vậy, vi sinh vật có khả năng đáp lại hệ thống miễn dịch gây nên bệnh. Những con chuột chứa các gen MMTV bội sinh khác nhau khác về các phần thụ thể tế bào T, làm giảm nguy cơ trong quần thể chuột có chứa nhiều MMTV. Cho đến nay chưa có trường hợp nào ở người có cơ chế tương tự của căn bệnh này. Người ta cho rằng toàn bộ kho dự trữ các peptit được nhận biết bởi các lympho T của một cơ thể, phụ thuộc vào cấu trúc của các phân tử MHC và phụ thuộc vào cơ thể dung nạp đối với các peptit của bản thân khi có sự biệt hóa của các tế bào lympho T. Nếu một lympho T của hệ thống miễn dịch có phản ứng chống lại các thành phần của bản thân thì sẽ đưa đến tình trạng bệnh tự miễn (autoimmunity diseases). Trong quá trình phát triển của hệ thống miễn dịch, khi các tế bào T nhận biết thành phần của bản thân cơ thể gây ra phản ứng đối kháng thì lập tức quần thể tế bào T đó bị loại bỏ bởi chính hệ thống miễn dịch. Các vi sinh vật có thể sử dụng những chiến lược khác nhau để tẩu thoát khỏi sự nhận biết của vật chủ bằng cách cải biến các peptit kháng nguyên của mình. Chúng có thể bắt chước các cấu trúc peptit của cơ thể vật chủ. Những sự cải biến này chỉ được xuất hiện nếu vi sinh vật sống lâu dài trong vật chủ. Đó là trường hợp của bệnh nhiễm trùng mãn tính. Cũng tương tự như vậy, các tế bào ung thư có thể bị phá hủy bởi hệ thống miễn dịch vì chúng hoàn toàn khác lạ với các tế bào bình thường của cơ thể. Tuy nhiên trong một số trường hợp các tế bào ung thư có thể tự cải biến kháng nguyên của chúng để trốn thoát khỏi sự phá hủy của hệ thống miễn dịch. Đó là ung thư tiến triển hoặc di căn. Như vậy bất kỳ tác nhân gây bệnh nào cũng có xu hướng tìm cách thoát khỏi cơ chế bảo vệ của cơ thể. Các virus gây bệnh cũng có xu hướng đa dạng. 
Chúng có nhiều cách khác nhau để thoát khỏi sự chống trả quyết liệt của cơ thể để có thể nhân lên bình thường. Bộ gen của một số loại virus ADN hoặc virus retro có thể gắn xen vào bộ gen của tế bào vật chủ có thể truyền cho các tế bào lân cận theo cơ chế truyền ngang hoặc cho các tế bào thế hệ sau theo cơ chế truyền dọc. Sự thay đổi bộ gen của các tế bào thực sự không lớn. Tế bào biểu hiện lượng kháng nguyên virus là tối thiểu nên chúng vẫn tồn tại yên ổn và không bị sức ép giám sát của hệ thống miễn dịch. Một số virus như virut Herpes, HIV, paramyxol có khả năng đi từ tế bào này sang tế bào khác trong tế bào một lớp, là do các tế bào hội nhập với nhau tạo nên tế bào khổng lồ đa nhân hoặc hợp bào chứa virus. Virus không ra khỏi tế bào do đó không bị hệ thống miễn dịch tấn công. Bên cạnh đó, trong cơ thể người có một số loại tế bào mà trên bề mặt không biểu hiện kháng nguyên MHC-I, do đó không bị các tế bào của hệ thống miễn dịch nhận diện, ví dụ các neuron thần kinh hay thủy tinh thể. Nếu virus nhân lên trong các tế bào ấy thì sẽ không tạo được phức hợp MHCI - peptit để đưa ra bề mặt tế bào cho các tế bào lympho nhận diện. Có thể nhận thấy ở virus adeno khi nhiễm vào tế bào thấy có hiện tượng ức chế biểu hiện phức hệ MHC-1- peptit virus. Sở dĩ như vậy vì có sự ức chế hoạt hóa protein đặc hiệu làm nhiệm vụ vận chuyển phức hệ này ra mặt tế bào bị nhiễm. Ở các retrovirus, trong quá trình nhân lên virus HIV có sự sai sót trong tổng hợp ADN. Đó là do sai sót trong mối tương tác với enzyme phiên mã ngược. Kết quả là xảy ra đột biến ở đoạn gen mã hóa cho glycoprotein gp120, làm mất đi khả năng tổng hợp kháng thể sớm chống virus. Còn có các virus có khả năng ức chế miễn dịch, ta có thể kể đến virus pox, trong quá trình nhân lên đã tiết phân tử hòa tan thuộc loại IFN và TNF-α (yếu tố hoại tử ung thư) phong tỏa hoạt động của các chất này của tế bào. Trong quá trình nhân lên, virus đậu bò cũng tạo thành protein tiết, tương tự như chất ức chế bổ thể C4 và có khả năng kìm hãm hoạt hóa bổ thể theo con đường cổ điển. Sự nhân lên của virus viêm gan B kèm theo sự tổng hợp một lượng lớn phân tử kháng nguyên bề mặt HbsAg. Phân tử này gắn với kháng thể tạo thành tấm lá chắn đặc hiệu giúp virut thoát khỏi tác động của kháng thể. 
Những nhân tố gây bệnh có thể gây nên các bệnh hoạt động có chu kỳ hay dai dẳng bằng cách lẩn trốn hệ miễn dịch bình thường của vật chủ hoạc phá hủy chúng để hoạt hóa quá trình tái bản của chính nó. Có nhiều phương cách khác nhau để lẩn tránh hệ thống miễn dịch. Biến đổi kháng nguyên, tiềm tàng, kháng cự lại hiệu quả của các cơ chế miễn dịch, và kìm hãm sự hoạt động của bộ máy miễn dịch, tất cả các phương cách trên gây nên những bệnh nghiêm trọng và dai dẳng. Trong một số trường hợp, đáp ứng miễn dịch là một phần vấn đề cần giải quyết, một số tác nhân gây bệnh dùng hệ miễn dịch để hoạt hóa để lan bệnh, một số khác không gây bện nếu nó không đáp ứng miễn dịch. Mỗi cơ chế trong số này hướng dân chúng ta điều gì đó về đáp ứng miễn dịch tự nhiên và các bệnh mắc phải, mỗi loại bệnh thì đòi mỏi nhũng phương cách chữa bệnh riêng. Một số thuật ngữ sử dụng trong bài:·Antigen Pregenting Cells (APCs): tế bào trình diện kháng nguyên là những tế bào của hệ miễn dịch bao gồm chủ yếu là các tế bào thực bào đơn nhân, đại thực bào, các tế bào có tua, hình cây (dendrictic cells và folicule dendritic cells), tế bào Langerhans của da và tế bào B; ·Epstein-Bar virus (EBV): là những herpes virus gây nhiễm chọn lọc trên các tế bào B của người bằng cách liên kết với các thụ thể của bổ thể (CR2 hoặc còn gọi là CD21). EBV thường liên quan chặt chẽ với các bệnh ung thư vòm họng; ·Hemagglutinin: Chất gây ngưng kết, ví dụ các lectine; ·Major histocompatibility complex (MHC): Phức hệ tương thích hay hòa hợp mô chủ yếu, ở người được gọi là HLA (Human Leukocyte Antigen); ·Staphylococcal enterotoxins (SEs): Nội độc tố củatụ cầu, gây nên ngộ độc thức ăn và cũng kích thích các tế bào T liên kết với các phân tử của MHC lớp II và vùng Vβ của những thụ thể tế bào T nhất định, nên các nội độc tố Staphyllococcus sp. là các siêu kháng nguyên. ·Superantigen: Siêu kháng nguyên, là các phân tử kích thích một tập hợp con các tế bào T bằng cách liên kết với các phân tử MHC lớp II và các vùng Vβ của những thụ thể tế bào T qua đó kích thích sự hoạt hóa các tế bào T có biểu hiện các đoạn gen Vβ đặc biệt. Các nội độc tố Staphyllococcus sp. là một trong các nguồn siêu kháng nguyên. C. Ký sinh trùng sốt rét tránh né hoặc trốn thoát hệ miễn dịch?Các nhà khoa học Mỹ vừa phát hiện ra các ký sinh trùng sốt rét đã trốn thoát hệ miễn dịch của người. Ký sinh trùng sốt rét Plasmodium falciparum (P. falciparum) đã liên tục thay đổi diện mạo của một protein mà nó đặt lên bề mặt của tế bào người như một thứ vũ khí tấn công. Tốc độ thay đổi của protein này quá nhanh khiến cho hệ miễn dịch không có đủ thời gian để tạo kháng thể chống lại nó. Phát hiện mới đã gây bất ngờ về mức độ tiến hóa của ký sinh trùng P. falciparum, cho phép nó duy trì tuổi thọ lâu dài, từ lúc ký sinh trên muỗi cho đến khi tấn công cơ thể người. Bí quyết của P. falciparum chính là khả năng thay đổi liên tục phiên bản của một protein có tên là PfEMP1- "quả mìn" mà nó gài trên bề mặt của các tế bào "con mồi". Tốc độ thay đổi protein PfEMP1 cực nhanh. Khi hệ miễn dịch còn đang lấn bấn tìm cách nhận diện để tạo kháng thể đối phó thì PfEMP1 đã "thay áo" trở thành một dạng khác. Cứ như thế, trò chơi trốn tìm lại được lặp lại. Các nhà khoa học đã biết được một họ gen có tên là var chuyên kiểm soát quá trình sản xuất protein PfEMP1. Trong hệ gen của ký sinh trùng sốt rét có ít nhất 50 gen var. Song các gen này không hoạt động đồng thời, mà chỉ có duy nhất một gen hoạt động vào từng thời điểm. Có thể nói, trong quá trình truyền bệnh của ký sinh trùng sốt rét P. falciparum, diện mạo của nó sẽ thay đổi từ một gen var này sang gen var khác và trong khi một gen được bật lên thì tất cả các gen còn lại đồng loạt tắt. 
Nhóm nghiên cứu đến từ Viện nghiên cứu Y học Howard Hughes đã bắt tay tìm hiểu vì sao các gen var lại có khả năng thống nhất và hoạt động nhịp nhàng như vậy. Họ phát hiện ra nguyên nhân nằm ở ADN của các gen var, trong đó một protein đặc biệt được ví như "bộ máy điều chỉnh thông tin im lặng 2" - SIR2, đóng vai trò làm "câm" ADN ở những gen var "im lặng". Theo tiến sĩ Alan Cowman, trưởng nhóm nghiên cứu, việc gỡ nhỏ các mắt xích trong cơ chế bật-tắt (on-off) các gen var có thể mở ra các hướng mới trong việc phát triển thuốc chống sốt rét, thậm chí cả vaccine chống lại chúng. Theo một công trình nghiên cứu của Viện Hàn Lâm khoa học Mỹ, các nhà nghiên cứu đang từng bước tiến gần hơn đến việc tạo ra một dòng muỗi chuyển gen có khả năng kháng KSTSR. Kết quả của nghiên cứu là dòng muỗi sạch KSTSR có tỷ lệ sống cao hơn những con muỗi bình thường khi nuôi bằng máu có Plasmodium sp. Theo Peter Atkinson, thuộc đại học California ở Riverside có thể đưa loại muỗi này vào tự nhiên và sử dụng như một tác nhân cạnh tranh sinh học, chấm dứt sự lan truyền dai dẳng của loại ký sinh trùng này trong quần thể. 
Các nghiên cứu trước đây đã cho thấy những con muỗi chứa KSTSR không thích nghi tốt như muỗi sạch bệnh. Dựa trên quan sát này, Marcelo Jacobs-Lorena thuộc Trường Y tế công cộng Johns Hopkins Bloomberg đưa ra suy luận rằng muỗi được chuyển gen kháng KSTSR có sức sống vượt trội các cá thể hoang dại. Về kết quả thực tế thú vị này, bản thân Jacobs-Lorena thừa nhận “Tôi đã từng tin rằng việc sử dụng phương pháp chuyển gen chỉ có hại mà thôi”. Thực tế, một số nghiên cứu khác cho thấy những cá thể muỗi được chuyển gen có thể phải chịu một số thiệt thòi trong thích nghi, bù lại lợi ích từ tính kháng KSTSR. Theo Mauro T. Marrelli, cũng thuộc trường Johns Hopkins, các nhà nghiên cứu đã so sánh sự thích nghi của muỗi An. stephensi hoang dại với các cá thể muỗi biểu hiện SM1, một peptide có khả năng ngăn cản KSTSR xâm nhập vào đường tiêu hóa muỗi. Những cá thể muỗi chuyển gen này không thể bị bệnh bởi P. berghei, một loại KSTSR nhiễm trên chuột. 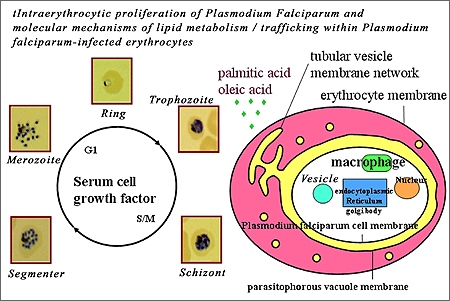
Các nhà nghiên cứu đã thả muỗi hoang dại và muỗi chuyển gen vào lồng và nuôi bằng máu chuột nhiễm Plasmodium sp. Sau 9 thế hệ, muỗi mang gen chuyển đã chiếm khoảng 70% tổng số. Các thí nghiệm bổ sung đã cho thấy các cá thể muỗi chuyển gen có tỉ lệ sinh sản cao và tỉ lệ tử vong thấp hơn dòng muỗi hoang dại trong điều kiện dinh dưỡng là máu chứa KSTSR đang phát triển. Atkinson nói “Đây là công việc thú vị, một số người đã luôn nói rằng những cá thể chuyển gen mà chúng tôi tạo ra sẽ khó có thể tồn tại, bởi những thay đổi di truyền là không có ý nghĩa về mặt thích nghi trong trường hợp này. Nhưng đây thực sự là một tin tức đáng khích lệ. Theo một nghiên cứu trước đây, muỗi chuyển gen kháng KSTSR đã được tao ra nhưng lại theo một hướng khác đó là làm gia tăng phản ứng miễn dịch của muỗi. Cái giá phải trả cho khả năng chống sốt rét tuyệt vời này là con muỗi mất khả năng cạnh tranh do phải dồn sức cho hệ miễn dịch của nó. Bài học này tương tự như cây chuyển gen chống hạn thì không sống tốt trong điều kiện mát mẻ. Theo Hilary Hurd thuộc đại học Keele ở Staffordshire, cho biết "Peptide SM1 có lợi thế do nó không phải là một phần của hệ̣ thống miễn dịch tự nhiên và vai trò chính của nó là ngăn chặn sự xâm nhiễm của KSTSR chứ không phải tiêu diệt chúng". Theo Jacob-Lorena, để có thể được đưa vào tự nhiên, các nhà khoa học vẫn cần phải nỗ lực hơn nữa để giải quyết rào cản trong cơ chế di truyền nhằm không chỉ gia tăng số lượng muỗi chuyển gen mà còn phải gia tăng hàm lượng gen chuyển trong các quần thể muỗi (nghiên cứu trên gen flow). Thậm chí kể cả khi muỗi chuyển gen vượt trội dòng hoang dại trong điều kiện thí nghiệm, thì cũng vẫn chưa đủ để có thể “đưa gen vào tự nhiên”. Nhưng những kết quả của họ đã cho thấy “để đạt đến thành công, có thể không cần một động lực mạnh như suy luận ban đầu nữa”. Theo Robert Sinden thuộc Trường Y khoa Hoàng gia Luân Đôn, bước quan trọng nhất chính là lặp lại các thí nghiệm này trên loại KSTSR gây bệnh cho người. Nếu các kết quả trên được lặp lại với cùng điều kiện này, chúng ta có lý do để lạc quan về tương lai. Một nghiên cứu khác của các nhà khoa học tại Đại học Johns Hopkins (Mỹ) đã khám phá một loại gen giúp giải thích tại saomuỗi không mắc bệnh sốt rét mặc dù chúng mang tác nhân gây bệnh.Nghiên cứu muỗi gây bệnh sốt rét, họ nhận thấy gen SPRN6 thường xuyên bị tắt và chỉ bật lên khi muỗi nhiễm KSTSR. 
Các nhà khoa học hy vọng việc loại bỏ hoàn toàn gen SPRN6 sẽ làm trì hoãn tiến trình tự nhiên, theo đó muỗi không bị nhiễm KSTSR. Các nhà khoa học hy vọng có thể phát triển những loại thuốc xịt hóa chất giúp kích thích việc tắt gen SPRN6 ở muỗi nhiễm tác nhân gây bệnh. Các con muỗi này sẽ không còn là mối đe dọa đích thực cho con người khi họ bị chúng chích, vì chúng sẽ không truyền ký sinh trùng Plasmodium sp. được. E. Ðánh lạc hướng hệ miễn dịch để phòng sốt rétViện Khoa học và Công nghệ Okinawa thuộc Đại học Graduate (Nhật Bản) đã xây dựng lại cấu trúc 3D của protein của P. falciparum - tác nhân gây bệnh sốt rét được truyền sang người qua vết đốt của muỗi Anopheles sp. Khi vào cơ thể, KSTSR sinh trưởng và nhiễm nhanh vào hồng cầu. Các chuyên gia sử dụng chiến lược dùng chính các tác nhân gây bệnh để khuếch đại xác suất lây lan, hình thành các cụm hoa thị xung quanh một tế bào máu nhiễm KSTSR. Trong các mạch máu, các cụm hoa thị liên kết với tường mao mạch làm cản trở lưu lượng máu bình thường, khiến cơ thể phản ứng với sốt cao. Trên thực tế, trẻ em và người cao tuổi có mao mạch mỏng hơn nên có nguy cơ mắc bệnh sốt rét cao hơn. Mấu chốt của vấn đề này là hình thành các protein PfEMP1 nhô ra của các hồng cầu nhiễm bệnh và đánh lừa KSTSR để tạo hệ thống phòng thủ chống lại bệnh sốt rét được gọi là kháng thể IgM. Các kháng thể IgM liên kết với các tác nhân gây bệnh hoặc các tế bào tác nhân gây bệnh nhiễm và gọi phân tử miễn dịch khác, như hệ thống bổ thể, để sao lưu. Các nhà nghiên cứu chỉ ra rằng các IgM kết hợp với một hoặc hai protein PfEMP1 để tạo thành một hình dạng giống bó hoa trên bề mặt của các tế bào bị nhiễm bệnh. Nhờ mô hình cấu trúc 3D của PfEMP1 và IgM, các nhà khoa học có thể thiết kế phương pháp điều trị bằng thuốc chống sốt rét để điều trị bệnh sốt rét. Nhìn chung, cơ chế đáp ứng miễn dịch chống lại các bệnh nhiễm trùng khác nhau nói chung và KSTSR cũng như giun sán nói riêng hiện vẫn còn nhiều vấn đề chưa giải thích hết, do vậy việc đi sâu nghiên cứu các khía cạnh này vẫn còn bỏ ngõ và đang tiếp tục đầu tư nghiên cứu bởi các nhóm nhà khoa học trên phạm vi toàn cầu. Hy vọng, trong tương lai, với các bằng chứng khoa học sẽ có những thuốc mới và vaccine hiệu quả chống lại các căn bệnh nguy hiểm với tỷ lệ mắc và tỷ lệ tử vong cao trong cộng đồng.
|

