Phần 1: http://impe-qn.org.vn/sinh-hoc-phan-tu/ky-nguyen-cong-nghe-vac-xin-mrna-va-phong-chong-benh-ky-sinh-trung-trong-tuong/ct/41/12938
III. ĐẶC TÍNH CỦA VẮC-XIN MRNA SO VỚI VẮC-XIN PROTEIN TÁI TỔ HỢP VÀ VẮC-XIN DNA
Bảng 1 trình bày sự so sánh đặc điểm của vắc-xin mRNA với vắc-xin DNA và vắc-xin protein tái tổ hợp. Cho đến nay, đã có các nghiên cứu phát triển vắc-xin mRNA chống lại ba loài ký sinh trùng đơn bào Plasmodium spp. [110-111], Leishmania donovani [112] và Toxoplasma gondii [113] cũng như ve chân đen Ixodes scapularis [114]. Tuy nhiên, hiện chưa có vắc-xin mRNA nào được phát triển chống lại các loài KST giun sán. Việc cải thiện hiểu biết về cơ chế hoạt động của vắc-xin mRNA sẽ là cần thiết để mở rộng nền tảng công nghệ mới này nhằm hướng tới các tác nhân gây bệnh khác, bao gồm cả ký sinh trùng giun sán.
Bảng 1. Đặc điểm của vắc-xin mRNA, vắc-xin DNA và vắc-xin protein tái tổ hợp
| Đặc điểm | Vắc-xin mRNA | Vắc-xin DNA | Vắc-xin protein tái tổ hợp |
| Ưu điểm | | | |
| Kích thích đáp ứng miễn dịch dịch thể và tế bào | + | +/– | +/– |
| Trình diện cả MHC-I và MHC-II | + | + | +/– |
| Khả năng phân cực/cân bằng đáp ứng Th1/Th2 | + | + | +/– |
| Cấu trúc tự nhiên/biến đổi sau dịch mã | + | + | – |
| Công thức và sản xuất đơn giản | + | + | – |
| Tốc độ tinh chế và biến đổi | + | + | – |
| Chi phí thấp | + | + | – |
| Độ ổn định | – | + | +/– |
| An toàn | + | +/– | + |
| Nhược điểm | | | |
| Hiệu quả vắc-xin thấp hơn | – | +/– | +/– |
| Tính sinh miễn dịch thấp | – | +/– | +/– |
| Cần tiêm nhắc lại | +/– | + | + |
| Nguy cơ phản ứng tự miễn | +/– | – | +/– |
| Nguy cơ tích hợp vào hệ gen vật chủ | – | + | – |
Chú thích: +/– Đặc điểm này có ở một số vắc-xin nhưng không phải tất cả.
1. Tổng quan và lịch sử của vắc-xin mRNA
Nghiên cứu về vắc-xin mRNA bắt đầu từ năm 1990, khi sự biểu hiện in vivo của ba loại protein (β-galactosidase, luciferase và chloramphenicol acetyltransferase) được chứng minh thành công sau khi tiêm riêng rẽ ba mRNA mã hóa các enzyme này vào cơ xương chuột (86). Tuy nhiên, vào thời điểm đó, do lo ngại về tính không ổn định của sản phẩm mRNA và khả năng kích hoạt phản ứng miễn dịch bẩm sinh ngoài ý muốn, báo cáo ban đầu này đã không thu hút được nhiều sự quan tâm từ giới nghiên cứu.
Một bước đột phá quan trọng xảy ra vào năm 2005, khi nhóm của Drew WeissmanvàKatalin Karikóphát hiện rằng việc biến đổi hóa học mRNA bằng cách thay thế uridine bằng đồng phân pseudouridine có thể làm tăng đáng kể khả năng biểu hiện protein, đồng thời làm giảm các phản ứng miễn dịch bẩm sinh không mong muốn (115). Phát hiện này đã thay đổi hoàn toàn cách nhìn nhận về tiềm năng dược phẩm của vắc-xin mRNA. Một điểm mấu chốt khác trong phát hiện của Weissman và Karikó là mRNA đã được biến đổi với độ ổn định cao hơn có thể được ứng dụng trong nhiều lĩnh vực can thiệp, bao gồm cả vắc-xin. Các biến đổi trong cấu trúc phân tử và quy trình sản xuất mRNA giúp ngăn ngừa hiệu quả tình trạng viêmthường do các phân tử mRNA chưa biến đổi gây ra. Nhờ vậy, mRNA đã biến đổi có thời gian hoạt động lâu hơn trong tế bào đích và tạo ra hiệu quả các kháng nguyên quan trọng, kích thích cơ thể chống lại bệnh tật.
Sau nghiên cứu mang tính bước ngoặt này, một khối lượng lớn các nghiên cứu phát triển tiếp theo đã được thực hiện, dẫn tới việc các cơ quan quản lý phê duyệt vắc-xin mRNA COVID-19vào năm 2020/2021. Hai công ty dược phẩm lớn là Pfizer-BioNTechvàModernađã phát triển thành công các vắc-xin mRNA COVID-19 đầu tiên, với hiệu quả bảo vệ khoảng 95% (116). Cả hai loại vắc-xin này đều vượt trội hơn so với 15 loại vắc-xin mRNA khác đã được phát triển nhằm chống lại các tác nhân gây bệnh khác và đã bước vào giai đoạn thử nghiệm lâm sàng cho đến cuối năm 2019, nhưng chưa có loại nào tiến triển đến giai đoạn 3 (117). Hai vắc-xin COVID-19 này đều sử dụng mRNA không nhân đôi, được biến đổi hóa học (115) để ngăn chặn hiện tượng hoạt hóa miễn dịch không mong muốn (118).
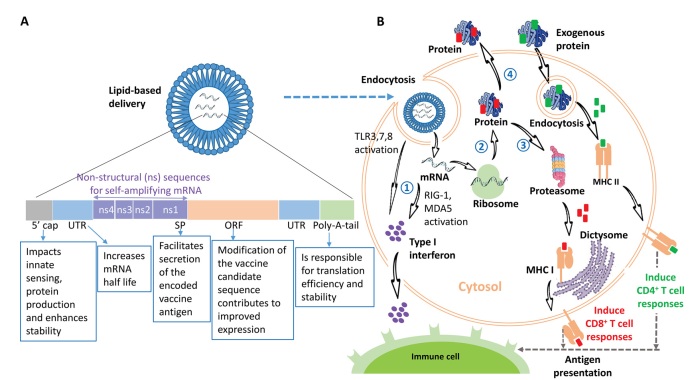
Hình 1.(A)Một vắc-xin mRNA điển hình bao gồm một khung đọc mở (ORF) mã hóa protein, được kẹp giữa hai vùng không dịch mã (UTRs), có vai trò điều hòa quá trình phiên mã và làm tăng độ ổn định của mRNA. ORF thường bắt đầu bằng peptide tín hiệu (SP), có thể thúc đẩy sự tiết ra của kháng nguyên mã hóa bởi vắc-xin. Bốn protein không cấu trúc (NSPs) bổ sung và các trình tự của mRNA tự nhân lên (SAM) được đặt trước SP. Bản phiên mã cần có mũ 5’ (5’ cap) để hỗ trợ quá trình sản xuất protein và một đuôi poly(A) ở 3’ nhằm cải thiện hiệu quả dịch mã cũng như độ ổn định nội bào. Cấu trúc mRNA được đóng gói trong hạt nano lipid (LNPs) để tạo điều kiện thuận lợi cho sự xâm nhập vào tế bào và hạn chế sự phân hủy.
(B) Cơ chế khởi phát đáp ứng miễn dịch do vắc-xin mRNA gây ra. mRNA được phiên mã in vitro được đóng gói trong LNPs và sau đó được các tế bào trình diện kháng nguyên (APCs), bao gồm đại thực bào hoặc tế bào tua (DCs), thu nhận thông qua cơ chế nội bào hóa (endocytosis). mRNA bị giữ lại sẽ thoát ra khỏi endosome và được vận chuyển vào bào tương.
- Bước 1: mRNA giải phóng sẽ hoạt hóa các thụ thể TLRs (TLR-3, -7, -8) và các thụ thể giống RIG-1 (RIG-1 và MDA5), từ đó kích hoạt sản xuất interferon loại I (77).
- Bước 2: mRNA được ribosome trong tế bào chủ dịch mã thành protein.
- Bước 3: Nếu protein không chứa SP, protein kháng nguyên sẽ được tạo ra trong bào tương và bị phân hủy bởi proteasome; tại đây, epitope kháng nguyên được tạo ra sẽ được vận chuyển vào lưới nội chất (ER) để gắn với phức hợp hòa hợp mô chính lớp I (MHC-I). Các phức hợp MHC-I mang epitope peptide được trình diện trên bề mặt tế bào sẽ kích hoạt tế bào T CD8+ đặc hiệu kháng nguyên sau khi nhận diện thông qua thụ thể T (TCR) cùng với sự đồng kích thích thích hợp.
- Bước 4: Nếu protein có chứa SP, các protein trưởng thành sẽ hoặc gắn vào màng tế bào hoặc được tiết ra khỏi tế bào chủ (tùy theo thiết kế mRNA). Các protein ngoại sinh này sẽ được APCs thu nhận qua nội bào hóa, các epitope peptide được tạo ra sẽ gắn vào MHC-II, và phức hợp MHC-II–epitope peptide khi được trình diện trên bề mặt tế bào sẽ kích thích tế bào T CD4+ đặc hiệu kháng nguyên (150), từ đó hỗ trợ cho cả tế bào T CD8+ và tế bào B. Ngoài ra, còn có thể xảy ra hiện tượng trình diện chéo (cross-presentation) vào MHC-I (239).
Cả MHC-I và MHC-II đều được vận chuyển đến màng sinh chất và trình diện các kháng nguyên cho tế bào miễn dịch, bao gồm tế bào B và T (15). Các interferon loại I tiết ra có thể kích thích hoặc ức chế hoạt hóa tế bào T, phụ thuộc vào cường độ và thời điểm đáp ứng interferon loại I được tạo ra (77, 240).Các nghiên cứu đã chứng minh rằng đáp ứng miễn dịch dịch thể (thông qua hoạt hóa tế bào B) là cơ chế chính được khởi phát bởi vắc-xin mRNA (241).
2. Cấu trúc của vắc-xin mRNA
Nguyên lý cơ bản của bất kỳ vắc-xin mRNA nào là vận chuyển một bản phiên mã quan tâm (mã hóa cho một hoặc nhiều kháng nguyên) vào bào tương, nơi mRNA sẽ được ribosome dịch mã in vivo. Bản phiên mã này có thể được thiết kế để dịch mã thành một protein nội bào, xuyên màng, hoặc tiết ra ngoài tế bào (119).Hiện có hai loại cấu trúc mRNA được phân loại:
- mRNA tự khuếch đại (SAM - self-amplifying mRNA)
- mRNA không sao chép (NRM - nonreplicating mRNA) (120) (Hình 1A).
SAM thường là phân tử có kích thước lớn hơn NRM và có khả năng mã hóa thêm bốn protein phi cấu trúc (NSPs) bên cạnh bản phiên mã mục tiêu. Các NSP này hỗ trợ quá trình phiên mã RNA bằng cách khuếch đại toàn bộ sợi RNA gốc cũng như sợi RNA kháng nguyên được mã hóa, từ đó làm tăng đáng kể biểu hiện protein. Vì vậy, SAM thường yêu cầu liều thấp hơn, ít nhất trong các mô hình tiền lâm sàng (121-122). Đặc điểm này đã được chứng minh trong nhiều mô hình động vật và ở người đối với các bệnh truyền nhiễm do nhiều tác nhân khác nhau như virus dại, virus cúm, virus hợp bào hô hấp (RSV), HIV và virus Ebola (15).
3. Đáp ứng miễn dịch do vắc-xin mRNA tạo ra
Quá trình khởi phát đáp ứng miễn dịch do vắc-xin mRNA được minh họa trong Hình 1B. Vắc-xin mRNA có khả năng kích hoạt cả miễn dịch bẩm sinh lẫn miễn dịch thích ứng (123). Điều quan trọng là cần hiểu rõ cách tế bào phản ứng và tự bảo vệ trước mRNA ngoại lai, từ đó khởi phát miễn dịch bẩm sinh cũng như cách chúng kích hoạt các chuỗi tín hiệu để dẫn tới hình thành miễn dịch thích ứng.Trong cấu trúc ba chiều của mRNA, các mô hình phân tử liên quan đến mầm bệnh (PAMPs) có thể được nhận diện và gắn kết bởi các thụ thể nhận diện mẫu (PRRs) trên bề mặt tế bào (124). Sự gắn kết này hình thành phức hợp PAMP-PRR, kích hoạt các con đường tín hiệu và thúc đẩy các yếu tố điều hòa đặc hiệu, qua đó tăng cường sản xuất cytokine tiền viêm và chemokine (125).
Các thụ thể Toll-like (TLRs) trong nội bào và họ thụ thể giống RIG-I (retinoic acid-inducible gene 1) đã được xác định là những thụ thể nhận diện mẫu (PRRs), đóng vai trò như “cảm biến RNA”. Trong đó, ba TLR gồm TLR3, TLR7 và TLR8, nằm trong các khoang nội bào của tế bào trình diện kháng nguyên (APCs), có vai trò quan trọng trong việc nhận diện RNA. Cụ thể:
- TLR3 nhận diện RNA sợi kép (dsRNA).
- TLR7 nhận diện cả dsRNA và RNA sợi đơn (ssRNA).
- TLR8 chỉ gắn kết với ssRNA (126).
Khi được kích hoạt, TLR3, TLR7 và TLR8 sẽ thúc đẩy sản xuất interferon loại I (IFN-α/β) (127).
Họ thụ thể giống RIG-I bao gồm RIG-Ivà MDA5 (melanoma differentiation-associated protein 5) (128). Trong đó, RIG-I nhận diện cả ssRNA và dsRNA, còn MDA5 chỉ gắn với dsRNA. Cả hai đều có khả năng kích hoạt IRF3 (interferon regulatory factor 3)và NF-κB (nuclear factor kappaB), từ đó làm tăng mạnh sự sản xuất interferon loại I (77, 129).Một phát hiện gần đây cho thấy NOD2 (nucleotide-binding oligomerization domain 2) cũng có thể được kích hoạt bởi ssRNA (130), sau đó hoạt hóa IRF3 để sản xuất IFN-β.Đáp ứng interferon do vắc-xin mRNA tạo ra thông qua sự kích thích TLR3, TLR7, TLR8, RIG-I và MDA5 phụ thuộc vào nhiều yếu tố: chất lượng của mRNA được phiên mã in vitro, mức độ biến đổi mRNA, cách thức vận chuyển cũng như đường đưa vắc-xin vào cơ thể (10).
Việc thay thế uridine bằng pseudouridine trong mRNA ngoại lai, cũng như tinh sạch mRNA bằng sắc ký lỏng hiệu năng cao (HPLC), có thể giúp giảm các phản ứng miễn dịch bẩm sinh không mong muốn, đồng thời tăng độ ổn định và khả năng biểu hiện của kháng nguyên (131-132). Ngoài ra, việc đóng gói mRNA đã biến đổi trong các hạt nano lipid (LNPs) còn có khả năng kích thích mạnh mẽ đáp ứng của tế bào T hỗ trợ (T helper), đồng thời tạo ra số lượng lớn tế bào B trung tâm mầm (germinal center B cells) sống lâu và các kháng thể có hiệu giá cao (133).
Vắc-xin mRNA có thể gây ra mức độ miễn dịch dịch thể mạnh mẽ thông qua việc kích hoạt các tế bào B nguyên sơ (naive B cells) (123). Các kháng thể đặc hiệu được sinh ra từ trung tâm mầm (GCs) trong nang tế bào B tại các cơ quan lympho thứ cấp. Khi tế bào B trưởng thành dưới sự hỗ trợ của tế bào T (134), chúng tạo ra đáp ứng kháng thể khi tiếp nhận kháng nguyên ngoại lai được trình diện bởi tế bào tua (DCs) (135). Nếu kháng nguyên được trình diện liên tục trong giai đoạn hình thành GCs, thì cả đáp ứng kháng thể kháng kháng nguyên lẫn đáp ứng phối hợp giữa tế bào B và tế bào T hỗ trợ nang (Tfh cells) đều được tăng cường (136), từ đó thúc đẩy sự duy trì đáp ứng kháng thể trung hòa lâu dài.
Các nghiên cứu trên mô hình động vật cho thấy rằng vắc-xin mRNA, ngay cả khi chỉ tiêm một hoặc hai liều với liều lượng thấp, cũng có thể tạo ra đáp ứng kháng thể trung hòa rất mạnh (109). Hơn nữa, các vắc-xin mRNA phòng SARS-CoV-2 đã chứng minh khả năng gây ra trí nhớ miễn dịch đa thành phần, duy trì trí nhớ lâu dài của cả tế bào B và T ngay cả khi nồng độ kháng thể suy giảm (137). Trí nhớ miễn dịch này có thể được tái kích hoạt nhanh chóng khi tái phơi nhiễm kháng nguyên, nhờ đó tiếp tục bảo vệ cơ thể chống lại tái nhiễm (137).
4. Ưu điểm của vắc-xin mRNA
Công nghệ mRNA mang lại nhiều ưu điểm, khiến nó trở thành một lựa chọn hấp dẫn so với các phương pháp phát triển vắc-xin truyền thống.
Thứ nhất, vắc-xin mRNA có thể được tạo ra nhanh chóng nhờ quy trình sản xuất tương đối đơn giản (138). Quá trình tổng hợp RNA dựa trên thông tin giải trình tự có sẵn của mầm bệnh mục tiêu và có thể được thực hiện nhanh chóng (trong vài tuần, thậm chí vài ngày), không giống như vắc-xin dựa trên protein tái tổ hợp thường đòi hỏi sự hiểu biết sâu về sinh vật mục tiêu và có thể mất nhiều năm để phát triển và sản xuất. Ngoài ra, nếu cần thay đổi kháng nguyên mã hóa, quy trình sản xuất vắc-xin mRNA chỉ cần điều chỉnh nhỏ ở khâu công thức và chế tạo mRNA mới, vì những thay đổi này không ảnh hưởng đến đặc tính vật lý và hóa học khung mRNA (139), giúp sản xuất dễ dàng tiêu chuẩn hóa và tương đối rẻ. Bên cạnh đó, sản xuất mRNA không cần tế bào và có khả năng mở rộng nhờ số lượng lớn sản phẩm thu được từ quá trình phiên mã in vitro (140).
Thứ hai, vắc-xin mRNA an toàn và có khả năng tạo ra mức độ miễn dịch mạnh, nổi bật ở bốn đặc điểm chính:
- Quá trình sản xuất vắc-xin mRNA dựa trên nền tảng không tích hợp, giúp cải thiện độ an toàn sinh học so với vắc-xin dựa trên DNA, bởi việc đưa mRNA chỉ cần sự tham gia trong bào tương để hoạt động và không thể tích hợp ngẫu nhiên vào bộ gen của tế bào chủ (141).
- Vắc-xin mRNA sử dụng nền tảng không lây nhiễm, do đó không mang các yếu tố lây nhiễm có nguy cơ nhân lên và gây đột biến bất lợi (109). Các vấn đề an toàn liên quan đến tạp chất có nguồn gốc từ tế bào và các chất ô nhiễm trong nuôi cấy, vốn thường gặp ở các nền tảng khác, dễ dàng tránh được trong quá trình phiên mã mRNA không cần tế bào. Không giống vắc-xin giảm độc lực hay vắc-xin bất hoạt, vắc-xin mRNA chỉ biểu hiện kháng nguyên cụ thể đã được mã hóa, từ đó tạo ra đáp ứng miễn dịch đặc hiệu và hiệu quả. Điều này được minh chứng bởi thành công của vắc-xin mRNA trong việc kích thích miễn dịch tế bào chống lại các tác nhân gây bệnh mà công nghệ truyền thống (“cổ điển”) thất bại (142).
- Sau khi được tiêm vào cơ bắp của vật chủ, mRNA sẽ được dịch mã thành protein bởi chính tế bào chủ. Điều này tạo ra cấu trúc protein tự nhiên đúng và các biến đổi sau dịch mã (như glycosyl hóa và phosphoryl hóa) tương tự như trong mầm bệnh sống, nhờ đó giúp hình thành kháng thể có đặc hiệu chính xác (143). Như đã đề cập, protein tái tổ hợp thường được biểu hiện trong hệ thống vi khuẩn (Escherichia coli hoặc Bacillus subtilis) hay hệ thống biểu hiện nhân chuẩn (144). Vì vậy, sản lượng, quá trình sản xuất và tính ổn định của protein tái tổ hợp tinh khiết, cùng với các biến đổi sau dịch mã của kháng nguyên đích, đều cần được cân nhắc, làm cho sản xuất vắc-xin trở nên phức tạp, tốn kém và mất nhiều thời gian.
- Việc biến đổi mRNA giúp chúng ổn định hơn và có khả năng dịch mã cao hơn, cho phép tăng dung nạp liều và kích thích đáp ứng kháng thể mạnh (145). mRNA đã được biến đổi có khả năng tạo ra đáp ứng miễn dịch mạnh bằng cách thúc đẩy cả miễn dịch tế bào và miễn dịch dịch thể, được chứng minh cả trong thử nghiệm lâm sàng và trên mô hình động vật (121, 142). Chỉ một liều mRNA cũng đã được chứng minh có thể tạo ra mức kháng thể trung hòa cao, yếu tố quan trọng để bảo vệ lâu dài chống lại nhiễm trùng (121, 146).
Thứ ba, một ưu điểm quan trọng khác của vắc-xin mRNA là khả năng đồng vận chuyển nhiều mRNA, tạo hiệu ứng hiệp đồng và thúc đẩy miễn dịch bảo vệ (147). Trước sự lan nhanh của các biến thể mới của coronavirus như Delta và Omicron, một chiến lược quan trọng là cập nhật vắc-xin COVID mRNA bằng cách sản xuất vắc-xin đa giá chống lại nhiều đột biến gai của Coronavirus nhằm duy trì hiệu quả bảo vệ (148). Những tiến bộ cũng đã đạt được trong phát triển vắc-xin mRNA đa giá chống lại virus cúm bằng cách xây dựng nền tảng có khả năng kiểm soát tốt, dễ mở rộng, và có thể tích hợp thêm các ứng viên vắc-xin mới trong thời gian ngắn (149). Cách tiếp cận này, hướng tới phát triển vắc-xin mRNA đa giá, có thể đóng vai trò then chốt trong việc tạo ra vắc-xin đa giá chống lại các ký sinh trùng phức tạp, bao gồm cả những loài giun ký sinh lớn, có ý nghĩa lâm sàng quan trọng như sán máng và giun móc.
5. LNPs - Hệ thống vận chuyển cho vắc-xin mRNA
Việc lựa chọn hệ thống phù hợp để vận chuyển mRNA đóng vai trò then chốt trong việc ngăn mRNA bị phân hủy, thúc đẩy sự xâm nhập vào tế bào, đảm bảo biểu hiện hiệu quả và dẫn đến sự hình thành đáp ứng miễn dịch mạnh và hiệu quả (150-151). Hệ thống vận chuyển mRNA cần được thiết kế theo yêu cầu y sinh học về khả năng tương thích sinh học và độ an toàn sinh học. Cho đến nay, nhiều phương pháp để vận chuyển vắc-xin mRNA đã được nghiên cứu, bao gồm các cách tiếp cận vận chuyển vật lý, nạp tế bào tua gai (dendritic cells) ex vivo, và sử dụng LNPs mang điện dương.
Các hạt nano đã chứng minh là phương pháp hấp dẫn nhất, đã được ứng dụng thành công trong lâm sàng để vận chuyển acid nucleic, bao gồm cả mRNA (108, 109, 152–156). Vận chuyển mRNA bằng LNPs kích thích đáp ứng miễn dịch bền vững và bảo vệ chống lại mầm bệnh và ung thư chỉ sau liều rất nhỏ (121, 157). LNPs bảo vệ mRNA khỏi sự phân hủy nhờ gắn các phối tử (ligands) trên bề mặt, có thể hướng đích đến loại tế bào mong muốn, và nếu cần thiết, có thể đồng vận chuyển với tá chất.LNPs tự sắp xếp thành các hạt có kích thước khoảng 100 nm, giúp vượt qua lớp màng lipid kép tích điện âm của màng tế bào, tạo thuận lợi cho việc giải phóng mRNA ra khỏi endosome vào bào tương, nơi quá trình dịch mã protein xảy ra (109). Các LNPs nhỏ hơn 150 nm có thể thoát lưu hiệu quả đến hạch bạch huyết qua mạch bạch huyết đến (158), trong khi các LNPs lớn hơn có thể bị thực bào bởi tế bào miễn dịch và vận chuyển đến hạch bạch huyết.Thông thường, LNPs bao gồm bốn thành phần:
- Lipid mang điện dương (ionizable) giúp tăng khả năng đóng gói mRNA, cải thiện hiệu quả xâm nhập tế bào và tạo thuận lợi cho quá trình thoát endosome;
- Cholesterol giúp ổn định cấu trúc phức hợp LNP;
- Polyethylene glycol (PEG) gắn lipid có thể giảm kích thước hạt, ngăn ngừa kết tụ, kéo dài thời gian lưu hành trong máu và giảm sự hấp thu bởi hệ võng nội mô;
- Phospholipid cần thiết để duy trì cấu trúc lớp lipid kép (109).
Mặc dù LNPs đã được nghiên cứu rộng rãi, nhưng các nền tảng vận chuyển tiềm năng khác vẫn cần được tiếp tục phát triển để tăng hiệu quả chuyển nạp, hướng đích đặc hiệu, tăng độ ổn định của mRNA được đóng gói, đồng thời giảm các tác dụng phụ phản ứng, từ đó cải thiện hệ thống vận chuyển nội bào, nâng cao hiệu quả chăm sóc sức khỏe và điều trị y tế.
6. Hồ sơ an toàn của vắc-xin mRNA khi được đóng gói trong hạt nano lipid (LNPs)
Báo cáo ban đầu về độ an toàn của vắc-xin COVID-19 Pfizer-BioNTech ghi nhận khoảng 11ca sốc phản vệ trên một triệu liều tiêm (bao gồm cả phản ứng không phải sốc phản vệ) sau liều đầu tiên (159). Phần lớn tác dụng phụ (ví dụ: đau tại chỗ tiêm, mệt mỏi, đau đầu, sốt, ớn lạnh, và liệt Bell) ghi nhận trong thử nghiệm lâm sàng không đe dọa tính mạng (138, 160).
Một số thành phần, chẳng hạn lipid PEGylated được thêm vào để ổn định và đảm bảo tính tương thích sinh học của vắc-xin LNP-mRNA có thể góp phần gây ra phản ứng dị ứng nặng, khả năng do dị ứng PEG sẵn có ở một số người được tiêm (161). Thực tế, đã có báo cáo cho thấy lipid PEG có thể kích hoạt hệ thống bổ thể, gây phản ứng quá mẫn (162-163).Một phản ứng miễn dịch ngoài mong đợi khác, hiện tượng tăng tốc thải trừ trong máu (ABC) cũng được quan sát trong các lần tiêm lặp lại với hạt nano PEGylated (164). Điều này có thể làm thay đổi sinh khả dụng và phân bố của mRNA được đóng gói, dẫn đến tác dụng phụ (162). Đây là mối lo ngại trong các ứng dụng miễn dịch trị liệu, khi cần nhiều liều để duy trì mức kháng thể bảo vệ cao.
Trước những lo ngại về an toàn này, nhiều thành phần tự nhiên hoặc tổng hợp khác (như heparin, dextran, chitosan và các polymer phân hủy sinh học/không phân hủy sinh học) đã được nghiên cứu thay thế PEG (162), nhưng lĩnh vực này vẫn còn ở giai đoạn sơ khai. Việc tối ưu hóa phương pháp vận chuyển mRNA phù hợp là rất cần thiết để vừa tăng hiệu quả miễn dịch bảo vệ, vừa giảm thiểu rủi ro liên quan đến vắc-xin (165).
7. Vận chuyển và Bảo quản Các Chế phẩm mRNA-LNP
Ban đầu, người ta cho rằng vắc-xin mRNA COVID-19 của Pfizer-BioNTech cần được vận chuyển ở nhiệt độ từ −80°C đến −60°C, có thể bảo quản trong tủ đông −20°C chỉ khoảng 2 tuần, và bảo quản ở 2-8°C chỉ trong 5 ngày. Điều này đồng nghĩa với việc chỉ có một số ít quốc gia có khả năng đáp ứng yêu cầu bảo quản ở nhiệt độ lạnh sâu như vậy.
Tuy nhiên, dữ liệu Pfizer gửi cho cơ quan quản lý sau đó cho thấy, các lọ vắc-xin đã rã đông nhưng chưa pha loãng có thể bảo quản ở 2-8°C đến 1 tháng. Ngay từ đầu, vắc-xin Spikevax của Moderna có yêu cầu về bảo quản lạnh ít nghiêm ngặt hơn: cần vận chuyển ở −20°C, có thể bảo quản đến 6 tháng ở −20°C, và sau khi rã đông, cũng có thể giữ ở 2-8°C trong 30 ngàye. Dù vậy, rõ ràng mỗi bước trong xử lý vắc-xin mRNA đều đòi hỏi sự cẩn trọng và phối hợp nghiêm ngặt (15), gây ảnh hưởng đáng kể đến khả năng tiếp cận vắc-xin (138). Yêu cầu này là rào cản kỹ thuật và gánh nặng kinh tế nếu vắc-xin mRNA cần được phân phối và bảo quản ở các cơ sở phù hợp tại các nước đang phát triển.
Do đó, cần có các chiến lược hệ thống để xác định các cơ chế hóa-lý chính gây phân hủy vắc-xin mRNA đã bào chế, vì hiện nay hiểu biết của chúng ta còn hạn chế (166). Ngoài ra, cần nghiên cứu thêm để xác định công thức tối ưu cho các vắc-xin LNP-mRNA nhằm đảm bảo duy trì ổn định ở nhiệt độ tủ lạnh hoặc nhiệt độ phòng trong quá trình vận chuyển, bảo quản và tiêm chủng (166). Các chiến lược có thể bao gồm: lựa chọn tá dược (ví dụ sử dụng chất bảo quản và chất ổn định), điều chỉnh môi trường công thức (ví dụ tác nhân điều hòa trương lực và/hoặc pH thích hợp), cải tiến công nghệ hạt nano lipid và phương pháp sản xuất, cùng các quy trình vận chuyển tối ưu (ví dụ sử dụng liều vắc-xin dạng đông khô hoặc dạng lỏng) (166). Lý tưởng nhất, những yếu tố này sẽ cho phép vận chuyển và bảo quản mRNA ở nhiệt độ khả thi trong toàn bộ chuỗi cung ứng vắc-xin (167), với việc cải thiện độ ổn định sẽ giúp người dân ở các quốc gia đang phát triển và vùng sâu vùng xa dễ dàng tiếp cận dịch vụ CSSK cơ bản và điều trị y tế.
(còn nữa) --> Tiếp theo Phần 3
TS. Nguyễn Thị Liên Hạnh & TS.BS. Huỳnh Hồng Quang
Viện Sốt rét-KST-CT Quy Nhơn