Sốt rét là một trong những căn bệnh gây tử vong hàng đầu trong số các bệnh truyền nhiễm nhiệt đới và cận nhiệt đới và cũng là vấn đề y tế công cộng ảnh hưởng đến gần 40% dân số thế giới, đặc biệt gánh nặng bệnh tật tại châu Phi và Đông Nam Á. Sự xuất hiện các chủng Plasmodium đa kháng thuốcP. falciparum (đa thuốc) và cả P. vivax (với chloroquine và primaquine) đã khiến cho các chiến lược điều trị và dự phòng tại một số vùng trở nên phức tạp rất nhiều và nhu cầu cần đến nhiều biện pháp giám sát nhạy-kháng thuốc sớm đưa ra cảnh báo và quy trình thường quy nhằm xác định kháng.
Như một số tác nhân gây bệnh khác, một số phương pháp sẵn có để đánh giá tính nhạy cảm của thuốc. Đối với các loài Plasmodium, từ lâu được xem là vua của các bệnh truyền nhiễm vì bao phủ tất cả triệu chứng và hội chứng của bệnh lý cũng như tính phức hợp trong chu kỳ sinh học (đa thể và đa giai đoạn), cơ chế bệnh sinh (trên đa cơ quan) đã khiến cho công tác giám sát ký sinh trùng kháng thuốc đôi khi gặp phải trở ngại khi triển khai từng phương pháp và kỹ thuật.
Phương pháp thử nghiệm lâm sàng dựa trên in vivo là một phương pháp áp dụng phổ biến rộng rãi nhất hiện nay và được chấp nhận là chuẩn vàng trong đánh giá nghiên cứu kháng thuốc sốt rét hiện nay. Test in vivo có thể thực hiện tại thực địa và môi trường bệnh viện, ưu điểm đánh giá sớm ngay qua bộ số liệu thô của liệu trình theo dõi, song tuyển chọn bệnh nhân đủ tiêu chuẩn và để bệnh nhân phối hợp tốt theo hết liệu trình giám sát dài ngày (28/ hoặc 42 ngày, thậm chí 56 ngày) là một nhược điểm;
Phương pháp thử nghiệm đánh giá nhạy kháng theo nồng độ thuốc cài đặt sẵn trong in vitro có ưu điểm là một thử nghiệm khách quan, cho kết quả sớm (trong vòng 24 - 48 giờ), không bị các yếu tố miễn dịch can thiệp vào kết quả. Để thực hiện được đạt kết quả chính xác và tin cậy cần thiết phải đào tạo nhân lực tính kiên trì, đam mê và có nhiều kinh nghiệm trong nhận định ký sinh trùng cũng như tuổi ký sinh trùng;
Sinh học phân tử với các kỹ thuật và công cụ hiện đại đã giúp cho việc định loài Plasmodium spp, xác định tái phát hoặc tái nhiễm sau khi điều trị hoàn tất liệu trình trong suốt quá trình theo dõi in vivo, các kỹ thuật này hỗ trợ rất nhiều cho in vivo trong xác định kháng thật sự, thực hiện được với tất cả các loài Plasmodium spp. Ngoài ra, sinh học phân tử còn phát hiện các đột biến kháng thuốc mức độ phân tử. Một trong những thách thức cho triển khai thực hiện các kỹ thuật sinh học phân tử này là cán bộ phải có kiến thức cơ bản, kinh nghiệm, trang thiết bị và hóa chất đắt tiền và thiết kế khu la bô chuyên biệt để tránh tạp nhiễm, giá thành một mẫu xét nghiệm khá cao;
Đo nồng độ hoạt chất và chất chuyển hóa trong nghiên cứu kháng thuốc, đặc biệt với P. vivax kháng với chloroquine là điểm mới trong nghiên cứu nhạy - kháng, ứng dụng thành quả của dược động học và sắc ký lỏng cao áp, song kết quả về nồng độ các chất trong huyết tương/ huyết thanh còn lệ thuộc vào nhiều yếu tố khác như thụ thể, protein gắn kết, dung nạp của bệnh nhân,…
Các phương pháp và kỹ thuật khác trong tương lai sẽ phối hợp với các kỹ thuật cổ điển trong việc đánh giá thấu đáo và hoàn chỉnh hơn, chi tiết hơn về ký sinh trùng kháng thuốc.
ĐÁNH GIÁ HIỆU LỰC THUỐC SỐT RÉT VỚI THỬ NGHIỆM IN VIVO
Thử nghiệm đánh giá hiệu lực phác đồ theo phương pháp in vivo liên quan đến việc thường quy đánh giá hiệu lực từng phác đồ đối với bệnh nhân (BN) sốt rét được điều trị với những phác đồ TSR đặc hiệu[51],[55],[56]. Sự tái xuất hiện KSTSR trong máu và có hay không có tồn tại triệu chứng lâm sàng được xem như chỉ điểm giảm nhạy/ kháng của KSTSR với thuốc đó. Khi những đánh giá in vivo được tiến hành đồng thời trong thời gian thích hợp và lựa chọn đại diện cho vùng LHSR, kết quả sẽ đóng góp xây dựng bản đồ SR kháng thuốc và góp phần thay đổi chính sách TSR phù hợp từng giai đoạn. Thử nghiệm in vivo có thể đánh giá đáp ứng của nhiều loài P. falciparum, P. vivax (hầu hết tại các quốc gia) và P. malariae (tại Indonesia).
Đánh giá in vivo được xem là thử nghiệm chuẩn vàng hiện nay trong đánh giá kháng thuốc sốt rét do Plasmodium spp, đánh giá hiệu lực TSR trực tiếp trên BNSR, thời gian đánh giá tùy thuộc vùng lan truyền (nếu vùng lan truyền vừa / cao: đánh giá hiệu lực 1 năm/ 1 lần; nếu vùng lan truyền thấp/ rất thấp: đánh giá mỗi 2 - 3 năm).
Đối tượng nghiên cứu:
Bệnh nhân sốt rét do P. falcipparum chưa biến chứng
Tiêu chuẩn chọn bệnh:
-Tuổi từ 6 tháng tuổi trở lên đến dưới 70 tuổi;
-Nhiễm đơn thuần loại KSTSR P. falciparum;
-Mật độ KSTSR thể vô tính P. falciparum từ 1.000 - 100.000/µl máu;
-Nhiệt độ nách/ ≥ 37.5 °C hoặc nhiệt độ dưới lưỡi/ đại tràng ≥ 38 °C;
-Chưa dùng một loại TSR nào (thông qua kiểm tra nước tiểu);
-BN, hoặc người giám hộ và thân nhân đồng ý hợp tác nghiên cứu.
Tiêu chuẩn loại trừ :
-Nhỏ hơn 6 tháng tuổi hoặc lớn hơn 70 tuổi;
-Phụ nữ đang có thai, hoặc đang cho con bú;
-Người đang có bệnh rối loạn tâm thần kinh, động kinh;
-Nôn mửa, tiêu chảy trầm trọng hoặc thể trạng không hấp thu được thuốc;
-Sốt rét có biến chứng hoặc mắc các bệnh nhiễm trùng phối hợp;
-Nhiễm phối hợp P. falciparum + P. vivax hoặc loại KSTSR khác;
-BN đã dùng TSR hoặc loại kháng sinh có hoạt tính chống SR trong vòng 48 giờ trước đó ;
-BN có tiền sử chấn thương lách hoặc cắt lách bán phần hoặc toàn phần.
Bệnh nhân sốt rét do P. vivax chưa biến chứng
Tiêu chuẩn chọn bệnh:
-Tuổi từ 6 tháng trở lên;
-Nhiễm đơn thuần KSTSR P. vivax được phát hiện bằng kính hiển vi;
-Mật độ KSTSR thể vô tính của P. vivax trong máu ≥ 250/µl máu;
-Nhiệt độ nách ≥ 37.5 °C hoặc tiền sử có sốt trong 48 giờ trước đó;
-Bệnh nhân có khả năng nuốt và uống thuốc;
-Không có biểu hiện một dấu hiệu đe dọa SRAT nào của P. vivax;
-Chưa dùng bất kỳ loại TSR nào trước đó (kiểm tra qua thử nước tiểu);
-Bệnh nhân và/ hoặc gia đình, người giám hộ đồng ý hợp tác, tham gia đủ liệu trình điều trị và theo dõi BN trong suốt thời gian nghiên cứu.
Tiêu chuẩn loại trừ :
-Nhỏ hơn 6 tháng tuổi và lớn hơn 70 tuổi;
-Phụ nữ có thai (test thử thai +) hoặc đang cho con bú sữa mẹ;
-Bệnh nhân sốt rét do P. vivax có biểu hiện biến chứng nặng (hôn mê, rối loạn ý thức, hội chứng suy hô hấp, thiếu máu nặng) đòi hỏi phải nhập viện, hoặc nôn trầm trọng hoặc thể trạng không hấp thu được thuốc;
-Hiện đang mắc bệnh nhiễm trùng phối hợp khác như tiêu chảy nặng, viêm hô hấp cấp, sởi, bệnh nền sẵn có nặng như gan, thận, tim mạch, HIV/AIDS, cúm nặng, suy dinh dưỡng;
-Nhiễm sốt rét phối hợp P. vivax + P. falciparum hoặc P. malariae, hoặc loài khác (chẳng hạn P. knowlesi);
-Bệnh nhân đã dùng thuốc chống sốt rét trong vòng 48 giờ trước đó;
-Bệnh nhân có tiền sử chấn thương lách, cắt lách bán phần hoặc toàn phần.
Các thuốc và phác đồ thuốc sử dụng trong nghiên cứu
-Các TSR dùng trong thử nghiệm tùy thuộc vào từng giai đoạn và yêu cầu thử nghiệm, hiện nay đang thử nghiệm phối hợp ACTs, CQ. Riêng đối với thuốc primaquine (PRQ) sẽ không chỉ định điều trị SR do P. vivax trong thời gian này vì khi cho đồng thời sẽ làm tăng hiệu quả hoạt tính CQ trên dòng KSTSR. Do vậy, sẽ cho PRQ sau khi kết thúc 28 ngày theo dõi;
-Phác đồ thuốc sử dụng trong nghiên cứu: hoặc dùng theo phác đồ thuốc đang sử dụng trong CTQGPCSR. Hoặc dùng phác đồ của một thuốc mới.
Thuốc điều trị thay thế
-Đối với BNSR nhiễm P. falciparum điều trị bằng ACTs biểu hiện không dung nạp thuốc (nôn mửa, tiêu chảy, nổi mẩn, dị ứng nặng) sau 2 lần cho thuốc lại vẫn không cải thiện. Chuyển sang dùng AS lọ hoặc quinine tiêm truyền kết hợp với tetracycline hoặc clindamycine 7 ngày;
-Đối với BNSR nhiễm P. vivax điều trị bằng CQ, biểu hiện không dung nạp thuốc, thì nên điều trị thuốc thay thế bằng AS tiêm, quinine tiêm, hoặc chuyển sang dùng thuốc ACTs;
-Tất cả BN trên sau khi xử trí phác đồ thay thế đều được theo dõi cho đến khi BN sạch KSTSR trong máu, cho loại khỏi nghiên cứu.
Thuốc hoặc biện pháp dùng đồng thời trong khi nghiên cứu
-Điều trị triệu chứng sốt được chỉ định và đặc biệt quan trọng ở trẻ em nhỏ, vì khi sốt trẻ có thể co giật và nhức đầu, nôn mửa. Điều trị triệu chứng sốt khi thân nhiệt BN ≥ 38°C với acetaminophen ngay trước khi điều trị thuốc sốt rét vào ngày D0;
-Các biện pháp hạ sốt cơ học khuyên được áp dụng (lau mát, quạt tay);
-Trong thời gian theo dõi, BN có nhiễm trùng khác đi kèm SR, phải điều trị kháng sinh thích hợp và TSR cho BN đủ liều và sẽ rút khỏi nghiên cứu.
Quy trình theo dõi bệnh nhân trước, trong và sau khi uống thuốc
-Những BN đủ tiêu chuẩn nghiên cứu sẽ cho một mã số riêng và chỉ định điều trị sau khi được giải thích đầy đủ về nghiên cứu và cam kết. Bất kỳđối tượng nào quyết định không tham gia nghiên cứu sẽ được khám và điều trị SR như thường quy hướng dẫn của Bộ Y tế 2009;
-Lịch trình theo dõi được chuẩn bị sẵn và có lịch hẹn rõ ràng cho bệnh nhân. Ngày bênh nhân bắt đầu đưa vào nghiên cứu và cho uống thuốc liều đầu tiên gọi là ngày đầu tiên hoặc D0.
-Tất cả BN sau khi uống thuốc được nghiên cứu viên giám sát trong 30 phút về dung nạp thuốc; nếu BN nôn mửa trong vòng 30 phút đầu sẽ được điều trị lại với liều tương tự, nếu nôn trong vòng 30 - 60 phút sẽ được cho thêm ½ liều và theo dõi tiếp 30 phút nữa, nếu nôn trở lại sẽ loại khỏi nghiên cứu sau khi đã điều trị thay thế bằng AS dạng tiêm;
-Tiếp đó, lịch trình theo dõi và đánh giá lại các thông số lâm sàng và KSTSR được tiến hành vào các ngày D1, 2, 3 và D7, rồi mỗi tuần theo dõi trở lại như trên vào D14, 21, 28, 35 và D42;
-Các BN sẽ được khuyên nên quay trở lại với nhóm nghiên cứu vào bất cứ ngày nào trong quá trình theo dõi nếu họ có triệu chứng khác thường xảy ra mà không cần đợi đến lịch hẹn tái khám. Đánh giá lâm sàng nhằm theo dõi ca thất bại điều trị và tác dụng ngoại ý tiềm tàng có thể xảy ra;
-Trong khi những BN được khuyến khích quay trở lại theo lịch hẹn của họ, chúng ta cũng phải đến khám và lấy lam máu tại nhà nếu họ không đến được. Liệu trình điều trị và lịch theo dõi cho đề cương này phải chặt chẽ để đảm bảo số liệu chính xác;
-Những BN lỡ không theo dõi D1, D2 và vì một lý do nào đó lỡ không uống 1 liều điều trị là rút khỏi nghiên cứu. Sau D3, BN thất bại ở D7 sẽ quay lại và theo dõi tiếp vào D8 (cũng như thế, theo dõi vào các ngày D13/15, D20/22,D34/36 và D41/43) có thể vẫn được quy vào nhóm nghiên cứu. Sự khác biệt trong đề cương hơn 1 ngày không cho phép vì cả độ an toàn và tính chính xác số liệu sẽ không còn.
Kỹ thuật nghiên cứu
Đánh giá thông số / dấu hiệu lâm sàng
Đánh giá lâm sàng sẽ thực hiện trên tất cả đối tượng và thực hiện khám thực thể vào thời điểm bắt đầu nghiên cứu (D0) cũng như vào các ngày D1, 2, 3, 7, 14, 21, 28, 35 và D42. Tiến hành điều tra bệnh sử, ghi nhận thông tin về tuổi, giới tính, địa chỉ liên hệ đầy đủ và ghi lại chi tiết.
Đo thân nhiệt
-Đo nhiệt độ tai hoặc ở nách thực hiện vào thời điểm bắt đầu nghiên cứu (D0) cũng như vào các ngày từ D1, 2, 3, 7, 14, 21, 28, 35, 42. Cặp nhiệt độ nách 2 lần/ ngày trong 4 ngày đầu, sau đó mỗi ngày 1 lần vào các ngày sau, đồng thời với lấy lam máu giọt dày và giọt mỏng;
-Nếu thân nhiệt < 36.00C, sẽ lấy lại thân nhiệt thêm lần nữa;
-Quy trình như trên sẽ thực hiện trong suốt quá trình nghiên cứu.
Cân nặng
-Thân trọng của BN đủ tiêu chuẩn đưa vào nghiên cứu được ghi nhận vào ngày D0 theo mức cân nặng gần đúng nhất của cân đã được hiệu chỉnh;
-BN không nên mặc nhiều lớp quần áo trong khi cân, đo;
-Sử dụng sàng lọc về cân nặng để loại trừ hay đưa vào nghiên cứu theo tình trạng dinh dưỡng BN cũng như dùng nó để cho liều thuốc;
-Đo vòng chu vi cánh tay trái của BN, ngay điểm giữa khớp khuỷu và vai, sai số đến 0.2cm. Đánh giá tình trạng phù bằng cách ấn ngón trỏ vào mặt lưng của 2 bàn chân trong 3 giây.
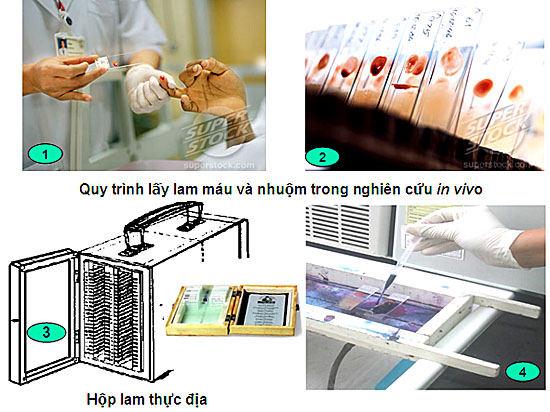 |
Quy trình làm lam máu in vivo đánh giá hiệu lực thuốc trên lâm sàng |
Xét nghiệm lam máu và đếm mật độ ký sinh trùng sốt rét
-Xét nghiệm lam máu giọt dày và mỏng, đếm KSTSR để sàng lọc vào ngày D0 và xác định tiêu chuẩn chọn BN hoặc tiêu chuẩn loại trừ.
-Lam giọt dày cũng sẽ kiểm tra vào các ngày tiếp theo từ D2, 3, 7, 14, 21, 28, 35 và D42;
-Những lam máu sẽ được đánh dấu, dán nhãn cẩn thận theo quy định ban đầu trong quy trình thực hiện nghiên cứu chuẩn của thử nghiệm lâm sàng quốc tế SOPs (số sàng lọc, mã nghiên cứu, ngày theo dõi và lấy lam máu,…);
-3 lam máu (2 lam giọt dày và 1 lam giọt mỏng) cho mỗi bệnh nhân, trong đó 1 lam sẽ nhuộm nhanh (giêm sa 10% trong 10 - 15 phút) đối với sàng lọc ban đầu, trong khi các lam khác chúng ta vẫn nhuộm chuẩn bình thường. Vì khi đủ tiêu chuẩn chọn vào nghiên cứu, chúng ta sẽ nhuộm lam thứ 2 cẩn thận hơn (nồng độ giêm sa 2.5 - 3.0% trong 45 - 60 phút);
-Phương pháp nhuộm chậm sẽ sử dụng cho các lam máu khác trong suốt quá trình theo dõi. Lam máu giọt dày cho sàng lọc ban đầu sẽ được kiểm tra và đếm thể vô tính trên vi trường;
-Lam giọt dày ban đầu sàng lọc sẽ sử dụng để đếm số KSTSR thể vô tính và số bạch cầu trong một số vi trường nhất định. Mật độ KSTSR đủ đưa vào nghiên cứu là ít nhất 1 KSTSR cho 3 bạch cầu, tương ứng 2.000 thể vô tính/ µl máu (đối với vùng lan truyền cao) hoặc ít nhất 1 KSTSR cho 6 bạch cầu, tương ứng 1.000 thể vô tính/ µl (đối với vùng lan truyền trung bình);
-MĐKSTSR đủ tiêu chuẩn đưa vào ≥ 1.000 thể vô tính/µl và mật độ KSTSR được tính như sau:
MĐKSTSR/µl = | Số lượng KSTSR đếm được x 8.000 |
Số lượng bạch cầu đếm được. |
-Hai xét nghiệm viên KHV chuyên về KSTSR sẽ soi độc lập tất cả lam máu và đếm MĐKSTSR bằng số trung bình của hai người. Các lam máu có kết quả không tương ứng (khác nhau giữa hai XNV về chủng loại KSTSR hoặc khác nhau về MĐKSTSR hơn 50%) sẽ được kiểm tra lại lần thứ 3 bởi một XNV độc lập và MĐKSTSR sẽ được tính số trung bình của hai người có giá trị gần tương đương nhau.
Đánh giá về một số thông số huyết học, sinh hóa
-Đánh giá huyết học của BNSR nên được làm các chỉ số haematocrite (Hct) hoặc haemoglobine (Hb) dựa trên các quy trình đơn giản thường làm tại phòng xét nghiệm (đặc biệt khâu này nên làm với thử nghiệm thuốc mới). So sánh giá trị giữa các ngày D0 và D7/ D14 yêu cầu có giá trị Hct hoặc Hb. Trên người khỏe mạnh, Hct (%) gấp khoảng 3 lần Hb (g/dL). Tỷ lệ này vẫn duy trì trong thiếu máu HC bình thường nhưng trong hầu hết thiếu máu ở vùng nhiệt đới tỷ lệ là 3.3:1. Nếu đểvào nghiên cứu nên chọn đối tượng có Hb > 5.0g/dL hoặc Hct >15%;
-Một số thông số hóa sinh thường làm liên quan đến đánh giá tác động TSR cũng như liên quan đến độ thanh thải thuốc,…do đó nên thực hiện đánh giá giá trị các thông số men gan ALAT, ASAT, ure, creatinine.
Xét nghiệm nước tiểu tìm thành phần thuốc sốt rét /nước tiểu
-Mẫu nước tiểu sẽ được lấy vào ngày D0 để tìm xem có sự có mặt các loại thuốc hoặc chất chuyển hóa của TSR khác nhau. Việc điều trị bằng TSR trước đó không phải là tiêu chuẩn loại trừ mà cần phải ghi nhận vào bệnh án nghiên cứu để phân tích thêm về kết quả;
-Phương pháp kiểm tra: Saker-Solomons, Lignin hoặc Dill-Glazko,…
Kiểm tra chất lượng thuốc trước khi nghiên cứu
-Thuốc sử dụng đánh giá hiệu lực phải đạt chất lượng, tốt hơn hết là lấy nguồn thuốc nhận về từ nguồn đạt chất lượng;
-Thuốc phải được thử cả hàm lượng và độ tan rã tại các la bô dược trước khi nghiên cứu bắt đầu nghiên cứu.
Một số trường hợp mất theo dõi trong quá trình nghiên cứu
-BN đã được vào nghiên cứu đang trong lịch trình theo dõi hoặc sau khi đã dùng đủ liều thuốc, nhưng không đến điểm theo đúng lịch trình;
-Các BN này sẽ được phân loại vào hoặc mất theo dõi hoặc loại khỏi nghiên cứu;
-Những BN bị mất theo dõi nhưng sau đó lại quay trở lại với nhóm nghiên cứu trước thời gian D28/ D42 thì sẽ không loại bỏ mà vẫn tiếp tục động viên đến khám vào các ngày tiếp theo;
-Nghiên cứu viên chính sẽ phân loại sau khi phân tích toàn bộ dữ liệu với các số liệu kèm theo trong hồ sơ gốc hay dữ liệu nguồn.
Bệnh nhân gián đoạn/ không tiếp tục hoặc vi phạm nghiên cứu
Những BN hội đủ bất kỳ một tiêu chuẩn nào sau đây sẽ được phân loại vào rút khỏi nghiên cứu:
-Bệnh nhân, cha mẹ hoặc người giám hộ xin rút đơn chấp thuận tham gia nghiên cứu bất kỳ thời điểm nào;
-BN đã không theo đủ liệu trình điều trị thuốc do:
+BN nôn trong khi cho uống thuốc mà không cải thiện gì được dù đã hai lần cho thuốc và nên điều trị thay thế bằng phác đồ khác, loại khỏi nghiên cứu, hoặc thất bại tham dự đủ liệu trình 3 ngày đầu thăm khám;
+Hoặc có xuất hiện các tác dụng phụ nghiêm trọng cần phải chấm dứt trước khi đủ liệu trình uống thuốc;
+Một bệnh nhân có thể gián đoạn tham gia nghiên cứu nếu nghiên cứu viên chính quyết định vì lý do các tác dụng ngoại ý biểu hiện nặng;
+Khi biểu hiện nghiêm trọng như thế, các thông tin về tác dụng, phản ứng nghiêm trọng phải được ghi lại đầy đủ vào bệnh án nghiên cứu;
+Nếu thật sự nghiêm trọng, nghiên cứu viên phải có quy trình báo cáo ngay lập tức với người chịu trách nhiệm giám sát về mặt lâm sàng.
Phân loại kết quả điều trị và độ an toàn của phác đồ thuốc sốt rét
Phân loại đánh giá kết quả điều trị của phác đồ
Hiện nay, tất cả các nghiên cứu thử nghiệm in vivo tại các vùng SRLH trên thế giới đều tuân theo đề cương của Tổ chức Y tế thế giới 2009
Ưu và nhược điểm phương pháp in vivo đánh giá hiệu lực thuốc sốt rét hiện nay.
Ưu điểm:
-Đánh giá in vivo được xem là thử nghiệm chuẩn vàng trong đánh giá nhạy - kháng TSR do Plasmodium spp.
-Tỷ lệ chữa khỏi (%) sẽ giúp cập nhật chính sách TSR quốc gia;
-Vừa đánh giá được tình trạng lâm sàng, KSTSR theo thời gian theo dõi liên tục 28/42 ngày, thậm chí 56 hoặc 74 ngày;
-Thiết kế nghiên cứu được cho cả P. vivax và P. falciparum với các TSR kể cả ACTs;
Nhược điểm:
-Bị ảnh hưởng bởi nhiều yếu tố nhiễu từ phía BNSR dẫn đến thời gian kéo dài để đáp ứng đủ cỡ mẫu nghiên cứu;
-Kết quả thử nghiệm in vivo lệ thuộc tình trạng miễn dịch cơ thể và ảnh hưởng bởi yếu tố nhiễu;
-Dễ mất mẫu do thời gian theo dõi dài và liên tục, khó đạt được chấp nhận của bệnh nhân do nhiều lý do;
-Tốn nhiều kinh phí và thời gian cho mỗi điểm sentinel.
KỸ THUẬT IN VITRO ĐÁNH GIÁ KHÁNG THUỐC THEO NỒNG ĐỘ
Giới thiệu sơ lược về nuôi cấy ký sinh trùng sốt rét
Nuôi cấy KSTSR là một phương pháp phát triển KSTSR trong môi trường in vitro. P. falciparum hiện là loài được nuôi cấy thành công nhất trong điều kiện in vitro. Mặc dù đã có nhiều nỗ lực cho việc nhân KSTSR bên ngoài cơ thể người hoặc mô hình động vật từ những năm 1912. Song, thành công ban đầu mới chỉ một hoặc vài chu kỳ, nuôi cấy thành công đầu tiên vào năm 1976 và khi đó họ hy vọng nhờ nuôi cấy này sẽ đưa họ đến việc phát triển một vaccine sốt rét nhanh chóng, song đến nay vẫn còn trong giai đoạn nghiên cứu và chỉ có thuốc mới lần lượt ra đời chứ không phải là vaccine. Hầu hết khi đó các nhà nghiên cứu đã nuôi cấy In vitro sử dụng loài KSTSR của chim là P. lophurae hoặc khỉ là P. knowlesi, nhưng thành công nuôi cấy liên tục trên bất kỳ KST là P. falciparum, điều quan trọng nhất là loài KSTSR. Hồng cầu ở người nhiễm KST được ủ trong một đĩa nuôi cấy cùng môi trường giàu chất dinh dưỡng hoặc huyết tương người. Một đặc điểm đặc biệt là môi trường ủ có một hỗn hợp khí đặc biệt, phần lớn là nitrogen (93% nitrogen, 4% carbondioxide, 3% oxygen) cho phép ký sinh trùng phát triển ở nhiệt độ cùng với thân nhiệt 37°C trong tủ ủ tế bào. Trong quá trình nuôi cấy, người ta dùng một cây nến để tạo hỗn hợp khí đó, nến sẽ tiêu thụ hết oxygen trước khi tạo ra bầu không khí như trên. Số ký sinh trùng sẽ nhân lên gấp đôi trong vòng 48 giờ. Mật độ KSTSR có thể được xác định thông qua xét nghiệm.
Hiện tại, các nhà sốt rét học đã áp dụng nhiều phương pháp, quy trình như nhau nuôi cấy cho các loài KST khác nhau để nuôi cấy đều đã thành công, gồm có P. fragile, P. inui, P. cynomolgi, nhưng các loài KSTSR này không mang lại giá trị và lợi ích thực tế hơn loài P. falciparum. Các phương pháp nuôi cấy cho P. vivax đã được báo cáo nhưng các kỹ thuật nuôi cấy này dường như phải đòi hỏi cung cấp liên tục một nguồn tế bào lưới của người và đây chính là một trong những trở ngại cho phần lớn các la bô nghiên cứu hiện nay. Sử dụng kháng nguyên ly trích từ nuôi cấy in vitro với P. falciparum để phát hiện kháng thể từ huyết thanh các bệnh nhân phơi nhiễm với P. vivax cũng là một nghiên cứu gần đây được áp dụng tại các la bô trên thế giới. KSTSR giai đoạn hồng cầu từ nuôi cấy in vitro của P. falciparum được ứng dụng để phát hiện kháng thể SR trên BNSR có huyết thanh nhiễm P. vivax thông qua phương pháp phát hiện kháng thể huỳnh quang gián tiếp (IFA).
Quy trình thử thuốc in vitro tại thực địa
Thử thuốc với Macrotest kit tại thực địa (Clyde, 1968)
Kỹ thuật này dựa trên sự so sánh quá trình phát triển của P.falciparum từ trophozoite thành schizonte giữa môi trường nuôi cấy không có thuốc với môi trường nuôi cấy có nồng độ thuốc từ thấp lên cao (0.25 - 3.0 nmol/ml).
Chọn bệnh nhân
-Nhiễm P. falciparum đơn thuần có mật độ KST 1.000 – 80.000/mm3.
-Không có bệnh nhiễm trùng khác phối hợp.
-Chưa dùng bất cứ loại thuốc sốt rét nào.
Tiến hành
-Xử dụng bộ thử Macrotest kit với CQ do TCYTTG cung cấp gồm: 2 ống chứng (màu trắng), 1 ống có 0,25 nmol CQ (màu vàng), 1 ống có 0,50 nmol CQ (màu xanh nước biển), 1 ống có 0,75 nmol (màu da cam), 1 ống có 1 nmol (màu xám), 1 ống có 1,25 nmol (màu nâu), 1 ống có 1,50 nmol (xanh da trời), 1 ống có 2 nmol (đen), 1 ống có 3 nmol (đỏ);
-Lấy 10 ml máu tĩnh mạch cho vào bình erlenmeyer chống đông;
-Lấy 1 ml máu cho vào mỗi lọ nuôi cấy, lắc đều;
-Để tủ ấm 37,50C, sau 24 giờ làm tiêu bản giọt đặc đếm số lượng thể hoa thị theo 300 bạch cầu.
Đánh giá nhạy cảm của KST P. falciparum so trên in vitro
-Nếu P. falciparum bị ức chế hoàn toàn ở nồng độ CQ 0,75nmol: Nhạy (S).
-Nếu P. falciparum vẫn phát triển thành schizonte ở nồng độ có 1.5 nmol CQ trở lên là kháng (R) RI, 3 nmol CQ tương đương với kháng RII và RIII;
-Hiện chưa có phương pháp nuôi cấy và thử thuốc trên in vitro đối với P. vivax chuẩn do ái tính của P. vivax với hồng cầu non nen việc chọn mẫu hơi khó, thứ hai là lượng hồng cầu lưới cho nuôi cấy P. vivax không đủ trong quá trình nuôi cấy, cũng như nồng độ chuẩn CO2 và O2 đủ cho nuôi cấy P. vivax chưa xác lập.
Thử thuốc với Microtest kit (Carl Rieckmann, 1978)
Kỹ thuật in vitro microtest được tác giả Carl Rieckmann giới thiệu năm 1978 và trở thành phương pháp chuẩn của TCYTTG từ năm 1980 đến nay. Quy trình để xác định sự nhạy cảm trong điều kiện in vitro của P. falciparum với TSR tại thực địa. Phương pháp có ưu điểm áp dụng cùng một thời điểm trên nhiều BN (trong cùng 1 đĩa thử), trên in vitro cho biết kết quả nhanh hơn in vivo, song lại có nhược điểm là chúng không thể thay thế được hoàn toàn kết quả in vivo mà chỉ mang tính chất bổ trợ kết quả đánh giá cho nhau[60].
Hiện nay chưa có bộ để thử thuốc cho KSTSR P. vivax vì nhiều lý do, trong đó đặc biệt là nhu cầu cung cấp hồng cầu lưới liên tục trong suốt quá trình nuôi cấy là hoàn toàn khó thực hiện và một số yếu tố khác.
Nguyên lý và cách tiến hành các bước của kỹ thuật
-Kỹ thuật microtest chỉ cần lấy 0,1ml máu đầu ngón tay, sau đó pha với 0.9ml môi trường nuôi cấy RPMI 1640 (loại môi trường được phát triển bởi Moore ở Roswell Park Memorial Institute, nên đặt tên là RPMI);
-Thường là một số thuốc đang được Chương trình TQGPCSR đang sử dụng;
-Giai đoạn HC của KSTSR sẽ phát triển trong ống nghiệm nếu được ủ ở37.50C trong môi trường nuôi cấy và giàu khí CO2. Thuốc có tác dụng ức chế sự tạo thành schizonte của KSTSR nhạy ở giai đoạn HC;
-Nên tạo môi trường đầy đủ khí CO2 và O2 như trong máu tĩnh mạch để nuôi cấy thành công tối đa, nếu chúng ta gặp chủng nhạy càng nhiều thì càng khó nuôi cấy đạt mục đích;
-Thông thường chu kỳ phát triển 48 giờ với nhiệt độ 37.5 ± 0.50C
Yêu cầu của kỹ thuật
-Đảm bảo vô trùng (vì đây là môi trường giàu chất dinh dưỡng rất hấp dẫn với vi khuẩn). Môi trường và phiến nhựa thuốc phải được bảo quản ở 40C;
-Đồng nhất về nguồn cung cấp thuốc thử, dung môi, quy trìnhkỹ thuật.
Nguyên liệu và dụng cụ
-Chọn bàn làm việc nơi không có gió lùa để tránh đưa bụi vào,…trước khi tiến hành nên đưa plate từ nơi cất giữ ra ngoài môi trường để ở nhiệt độ phòng cho ấm, rồi mới đưa mẫu máu có KST vào nếu không KST dễ chết (do nhiệt độ môi trường không phù hợp);
-Phiến nhựa 96 giếng đáy phẳng đã được cài đặt thuốc cần thử theo các nồng độ khác nhau. Những phiến nhựa này có thể nhận từ TCYTTG hoặc tự pha (do Viện Sốt rét KST- CT TƯ pha sẵn theo các nồng độ quy định). Cần lưu ý là thuốc ART và một số dẫn chất khi pha xong để được trong thời gian rất ngắn;
-Ống mao dẫn tráng chất chống đông (chuyên dụng cho nuôi cấy);
-Miếng nhựa plastic dính dùng để dán lên mặt trên phiến nhựa;
-Dao nhỏ cắt giấy nhựa, cẩn thận không để bột rơi vãi;
-Dung dịch môi trường nuôi cấy RPMI 1640 vô trùng;
-Dung dịch NaHCO3 5% (vô trùng);
-Pipet eppendorff cps thể hút các thể tích khác nhau 1ml; 0.2ml; 50µl;
-Các đầu col vô trùng chuyên dụng cho những pipet này,
-Tube để đựng môi trường có dung tích 5ml (vô trùng).
-Bình nuôi cấy và nến đốt không tạo khói,
-Tủ ấm, bình ắc quy và dụng cụ sạc ắc quy, tủ lạnh, bông, cồn 700
-Lam kính thường, lam kính chuyên dụng in vitro, dung dịch giêmsa, KHV.
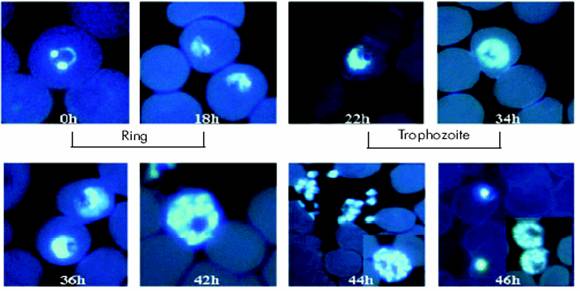 |
Giai đoạn phát triển của P. falciparum trong hồng cầu. Hình ảnh KST nuôi cấy được synchronized nhuộm bằng DAPI
(4’6 diamidino-2 phenylindole, chụp ảnh hiển vi dưới KHV huỳnh quang dưới tia UV |
Quy trình tiến hành
Tiêu chuẩn chọn bệnh nhân:
Bệnh nhân nhiễm loại KSTSR P. falciparum đơn thuần;
-Mật độ KSTSR thể vô tính từ 1.000 - 80.000 KST/µl máu (nếu lớn hơn sẽ không đủ lượng dinh dưỡng để nuôi);
-Phát hiện việc dùng thuốc (không được uống TSR trước đó):
+Phát hiện thuốc trong nước tiểu bằng test Dill-Glazko phải (-). Hỏi tiền sử dùng thuốc: BNSR không dùng thuốc ART và dẫn suất trước đó 7 ngày hoặc lâu hơn tùy thuộc đào thải từng loại thuốc;
+Trong trường hợp nghi ngờ, thử nghiệm có thể được tiến hành, nhưng phải lấy máu để phân tích về sự tồn lưu của thuốc;
-Khi bệnh nhân đủ tiêu chuẩn, tiến hành các bước tiếp theo.
+Kiểm tra nhiệt độ tủ ấm có ổn định không và làm ấm bình nến.
+Chuẩn bị môi trường nuôi cấy và làm ấm môi trường.
-Công thức pha môi trường RP: + 10 ml môi trường;
+0.4ml NaHCO3 5%
-Công thức tạo hỗn dịch máu- môi trường cho 1 thuốc thử:
+ 0.9 ml môi trường RPMI
+ 0.1 ml máu toàn phần từ bệnh nhân.
Lấy máu nuôi cấy tại thực địa
-Sát trùng đầu ngón tay bằng bông cồn 700 (thường là ở ngón nhẫn, bàn tay trái), để khô tự nhiên; dùng kim chích đầu ngón tay, nặn máu, dùng bông khô (vô trùng) lau giọt máu đầu. Vuốt nhẹ đầu ngón tay từ dưới lên, để máu ra từng giọt, dùng ống mao dẫn lấy 0.1ml máu, đẩy máu từ ống mao dẫn vào tube chứa sẵn 0.9 ml môi trường (nên lấy máu liên tục, không để ngắt quãng, oxygen dễ chen vào);
-Làm 2 lam máu: một lam giọt dày, một lam giọt mỏng;
-Có thể lấy máu tĩnh mạch để nuôi cấy (nếu mật độ 3.000 KST/µl máu), cần quyết định giờ nuôi khi nào cho thích hợp từng loại ký sinh trùng;
-Chú ý tủ ấm phải điều chỉnh nhiệt độ phù hợp trước khi nuôi cấy!
Chuyển máu vào phiến nhựa (plate)
-Dùng dao cắt hoặc dùng cái cưa răng mịn cắt phiến nhựa dính trên các giếng, mỗi thuốc cắt một cột, có thể thử 2 cột với lượng máu kể trên.
Lưu ý: Nên nuôi thêm 3 giếng trên một phiến nhựa vô trùng, không có thuốc để thăm dò sự phát triển của KSTSR trước giờ thu hoạch tốt nhất.
-Dùng pipet eppendorff, nhỏ 50µl hỗn dịch [máu + môi trường] vào mỗi giếng thử, bắt đầu từ giếng A và đi theo trình tự, cuối cùng là giếng H nghĩa là nồng độ cao dần (có thể dùng một đầu tip). Luôn luôn vừa làm vừa lắc tube để đảm bảo dịch treo như nhau;
-Vừa hút, vừa lắc lọ dung dịch, gõ nhè nhẹ plate cho hòa thuốc với dung dịch. Đậy nắp phiến nhựa, ghi số hiệu bệnh nhân, thời gian bắt đầu nuôi trên nắp theo đúng cột tương ứng;
-Vì lượng hỗn dịch nhỏ vào giếng rất ít nên có khả năng dính trên thành giếng, do vậy sau khi đậy nắp phiến nên gõ ngón tay và lắc nhẹ nhàng phiến nhựa;
-Lấy bình nến ra ngoài tủ ấm, đặt phiến nhựa vào bình nến, đặt một đĩa nhựa có miếng bông thấm nước cất vào bình (làm giảm sự bay hơi của môi trường), đốt nến, đậy nắp bình nến, khi nến gần tắt, khoá van của bình nến;
-Đặt bình nến vào tủ ấm, cài đặt nhiệt độ tủ ấm ở 37.5oC;
-Thời gian thu hoạch: dựa vào hình thể KSTSR lúc đưa vào nuôi cấy. Nếu các KSTSR trẻ thì thời gian ủ ấm từ 33 - 35 giờ, KSTSR giai đoạn trung bình thì thời gian ủ ấm từ 28 - 32 giờ, KSTSR già thì chỉ nên ủ ấm khoảng23–25 giờ. Nên thăm dò trước ở các giếng nuôi thêm (đề cập ở trên) trước khi thu hoạch mẫu (đó là lý do nuôi thêm 3 giếng trên một phiến nhựa vô trùng không có thuốc). Nếu kết quả chưa đạt, ta nên tiếp tục ủ thêm vài giờ nữa (nếu cần thiết);
-Trước khi đặt plate vào môi trường nuôi cấy nên có giữ độ ẩm (lấy cục bông thấm nước bỏ vào trong).
Thu hoạch, nhuộm lam và xét nghiệm lam đánh giá sau nuôi cấy
-Vì sau một thời gian dài nuôi cấy, ủ trong tủ ấm nên phần lớn hồng cầu lắng xuống phía dưới, ta dùng pipet eppendorff hút dịch nổi ở trên, hồng cầu còn lại lắng bên dưới được lấy làm thành những giọt máu dày trên lam chuyên dụng, trình tự 2 dãy theo quy định;
-Lấy lam chuyên dụng cho nuôi cấy, đánh mã (code) bệnh nhân và bắt đầu tiến hành. Chú ý: nếu thu hoạch từ giếng A- H thì đầu tip phải được đổi sau mỗi giếng thực hiện xong, có thể dùng 1 đầu tip để thu hoạch từ giếng H-A (nghĩa là trình tự ngược lại so với lúc đưa hỗn dịch vào trong giếng)
Well A Well B Well C Well D
Well E Well F Well G Well H
(nồng độ thuốc cao nhất)
-Nhuộm lam: lam máu phải được làm khô cẩn thận (để ở nhiệt độ phòng trong 10 giờ hoặc trong tủ ấm 37.50C qua đêm);
-Thường nhuộm với dung dịch giêm sa nhuộm nồng độ 1- 2%, dung dịch đệm pH = 6,8 trong 30-45 phút (cần kiểm tra nồng độ giêm sa và thời gian thích hợp trước khi nhuộm).
Đếm mật độ thể và đánh giá ký sinh trùng sốt rét
-Một mẫu thử được đánh giá là thành công khi số lượng schizonte ở giếng chứng phải bằng hoặc lớn hơn 10% trong tổng số 200 KSTSR thể vô tính.
-Đếm số lượng schizonte từ 3 nhân trở lên trong tổng số 200 KSTSR thể vô tính (bao gồm cả schizonte và tư dưỡng).
Phân tích số liệu
-Số liệu có ý nghĩa khi thực hiện thành công 30 mẫu thử hoặc hơn.
-Hiện nay trên thế giới có sử dụng một chương trình để đánh giá nhạy kháng thuốc sốt rét trên in vitro rất tiện lợi.
Xác định các chỉ số đánh giá trong nghiên cứu in vitro
-Dựa vào sự ức chế hoàn toàn thể tư dưỡng thành phân liệt so với chứng. Tỷ lệ (%) schizont bị ức chế ở mỗi nồng độ thuốc so với chứng;
-Ống chứng phải có ít nhất 10% thể tư dưỡng à thành thể phân liệt (20 thể trong 200 thể trophozoites);
-Nồng độ ức chế đạt 50% (IC50); 90% (IC90) hoặc 99% (IC99) sự phát triển của KSTSR và độ tin cậy (CI) là 95%;
-Các chỉ số trên được xác định dựa trên:
+Phần mềm của Wernsdorfer, (1995);
+Phần mềm mới HN-Nonlin (2009) để đánh giá nhanh và tiện lợi hơn với số liệu cập nhật và tính ra các chỉ số IC50, IC90, IC99, EC50, IC90, IC99.
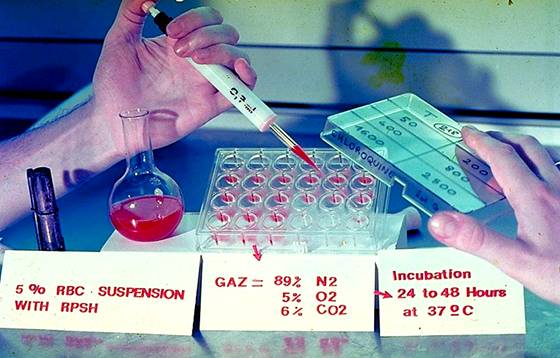 |
| Quy trình thử thuốc trên plate đã chứa sẵn loại thuốc từng nồng độ khác |
Xác định mức nhạy, kháng in vitro theo nồng độ tiêu chuẩn của WHO
Xác định kháng in vitro được rút ra từ đáp ứng in vivo của những BNSR không có miễn dịch;
Tiêu chuẩn nhạy, kháng in vitro trong bảng dưới đây tương quan với đáp ứng in vivo ở những BNSR không miễn dịch:
Bảng 4. Ngưỡng đánh giá nhạy – kháng từng loại thuốc sốt rét
Loại TSR cần đánh giá | Đáp ứng nhạy (không phát triển schizont ở) | Đáp ứng kháng (Phát triển schizont ở) |
Chloroquine | 4 pmol hoặc thấp hơn | 8 pmol hoặc cao hơn (1) |
Mefloquine | 16 pmol hoặc thấp hơn | 32 pmol hoặc cao hơn |
Quinine | 128 pmol hoặc thấp hơn | 256 pmol hoặc cao hơn |
Amodiaquine | 2 pmol hoặc thấp hơn | 4 pmol hoặc thấp hơn |
Halofantrine | 1,5 pmol hoặc thấp hơn2 | 5 pmol hoặc cao hơn* |
Artemisinine | 3 | 3 |
Pyronaridine | 3 | 3 |
Piperaquine | 3 | 3 |
1 nếu ở nồng độ 8 mà vẫn còn schizonte thì có thể xem là kháng thuốc
2 và 3là những nồng độ đánh giá ngưỡng nhạy - kháng chưa có thống nhất cũng như chưa có tiêu chuẩn cụ thể từ chương trình sốt rét toàn cầu (WHO/GMP_Global Malaria Programme) và Mạng lưới kháng thuốc sốt rét thế giới (WWARN_World-wide antimalarial drug resistance).
Ưu điểm và nhược điểm thử nghiệm đánh giá hiệu lực in vitro
Ưu điểm
-Cả hai phương pháp đều dùng đánh giá nhạy kháng TSR tại thực địa;
-Có thể thử nghiệm cùng lúc nhiều nồng độ thuốc trên cùng một đĩa;
-Công cụ để giám sát từng đơn thuốc, đặc biệt là artemisinine;
-Góp phần số liệu vào hệ thống cảnh báo sớm;
-Thực hiện kỹ thuật này tại cả tại thực địa lẫn trong la bô;
-Không bị hoặc ít bị ảnh hưởng bởi yếu tố miễn dịch cơ thể.
Nhược điểm
-Có thể phù hợp/ không phù hợp với đánh giá trên lâm sàng;
-Thiếu ngưỡng chuẩn hóa cho đủ các loại TSR, đặc biệt một số thuốc mới (ART, DHA, piperaquine phosphate);
-Không dùng kết quả này để điều chỉnh chính sách TSR quốc gia.
-Tuy nhiên, thử nghiệm khó áp dụng rộng rãi ở vùng sâu vùng xa, nguy cơ đối mặt với tạp nhiễm, trang thiết bị phức tạp, đòi hỏi thành thạo về kỹ năng và có kinh nghiệm về soi KSTSR.
Quy trình kỹ thuật thử thuốc sốt rét tại la bô
Hiện nay, Hầu hết các Viện Sốt rét - KST - CT trong toàn quốc đang áp dụng phương pháp thử thuốc 48 giờ của tác giả Nguyễn Đình Phúc (1980).
Mục đích
Quy trình này mô tả phương pháp để xác định sự nhạy cảm in vi tro của P. falciparum với thuốc sốt rét tại la bô. Ngoài ra, phương pháp này còn được dùng để đánh giá hiệu lực in vitro của thuốc SR cũng như sàng lọc các chất có hoạt tính chống SR.
Nguyên lý
Giai đoạn HC của KST sẽ phát triển trong ống nghiệm nếu được ủ ấm 37.0 - 37.5oC trong môi trường nuôi cấy và giàu khí CO2. Thuốc có tác dụng ức chế sự phát triển và nhân lên của KST ở giai đoạn HC.
Đối với thử nghiệm đánh giá sự nhạy cảm thuốc in vitro của các phân lập thu thập từ thực địa:
Thử nghiệm được tiến hành khi các phân lập đã thích nghi với điều kiện nuôi cấy tại la bô, có khả năng nhân lên tương tự như chủng T96 và K1. Chủng T96 và K1 được thử đồng thời với các phân lập mới. Thuốc được lựa chọn đưa vào thử là các thuốc đang được CTQGPCSR chỉ định dùng để điều trị BNSR. Thuốc được dùng làm chứng là CQ.
Đối với đánh giá hiệu lực in vitro của thuốc, hoặc sàng lọc các chất có hoạt tính với KST sốt rét: tiến hành thử trên chủng chuẩn nhạy CQ (T96) và chủng chuẩn kháng CQ (K1) và thuốc được dùng làm chứng là CQ.
Yêu cầu của kỹ thuật
-Biết nuôi cấy KST P. falciparum dài ngày
-Đảm bảo vô trùng
-Thao tác chuẩn xác
Xác định nồng độ an toàn của dung môi
Nguyên liệu, dụng cụ giống như kỹ thuật nuôi cấy dài ngày P.falciparum:
-Chủng chuẩn nhạy chloroquin (T96)
-Chủng chuẩn kháng chloroquin (K1)
-Thuốc làm chứng là chloroquin
-Thuốc thử khác, dung môi, phiến nhựa 96 giếng, pippet eppendorff
-Tube đựng dung dịch thuốc, môi trường đầy đủ, huyết thanh, hồng cầu.
Phương pháp tiến hành
Chuẩn bị KST cho thử thuốc
KST cần được cấy thêm cho thử thuốc trước khi thử 2 ngày để đạt đến mật độ 3 - 5% hồng cầu nhiễm. Tiến hành làm giảm mật độ KSTSR xuống còn 0.25 - 0.3% và hematocrite 40% .Thể tích mẫu nuôi cần được tính trước, dựa trên số lượng thuốc thử, dãy nồng độ thuốc và số giếng thử.
Chuẩn bị thuốc thử
-Xác định dung môi của thuốc, xác định dãy nồng độ thuốc,
-Cân thuốc, pha thuốc.
Tiến hành thử thuốc
-Thử nghiệm được tiến hành trên phiến nhựa 96 giếng;
-Mỗi nồng độ được thử trong 2 giếng. Mỗi giếng của thử được nhỏ 100l môi trường không thuốc cho giếng chứng và 100l môi trường có thuốc cho các giếng thử. Mỗi giếng thử được nhỏ 10l dịch treo hồng cầu nhiễm 0,25 – 0,3% và hematocrite 40%;
-Phiến nhựa được đặt vào bình nến, đưa bình nến vào tủ ấm 370C, ủ ấm 48 giờ. Sau 24 giờ thay khí và sau 48 thu hoạch. Lấy mẫu nuôi ra, làm lam giọt mỏng. Nhuộm giêm sa, soi trên KHV và đếm số lượng hồng cầu nhiễm KSTSR/10.000 hồng cầu để xác định IC50 và MIC.
-Thử nghiệm được tiến hành 2 lần, mỗi nồng độ mẫu thử được thử 2 giếng.
Phân tích số liệu
-Xác định nồng độ ức chế 50% (IC50) sự phát triển của KST: dựa trên phần mềm Probit (nồng độ ức chế tối thiểu (MIC) là nồng độ mà ở đó mật độ KST sau khi thử bằng mật độ KST đưa vào thử, dựa theo tiêu chuẩn của Beal-Thai Thong, 1983);
-Hoặc hiện nay, chúng ta có thể nhập toàn bộ dữ liệu trên nuôi cấy và thử thuốc nhạy, kháng vào phần mềm Non-line IC50 cũng có thể máy tự tính cho ra các nồng độ ức chế thuốc chuẩn như mong muốn.
ỨNG DỤNG SINH HỌC PHÂN TỬ TRONG NGHIÊN CỨU KHÁNG THUỐC SỐT RÉT
Phương pháp PCR là một kỹ thuật sinh học phân tử có độ nhạy và độ đặc hiệu cao trong việc phát hiện, chẩn đoán và theo dõi điều trị nhiều bệnh nhiệt đới, trong đó có SR.
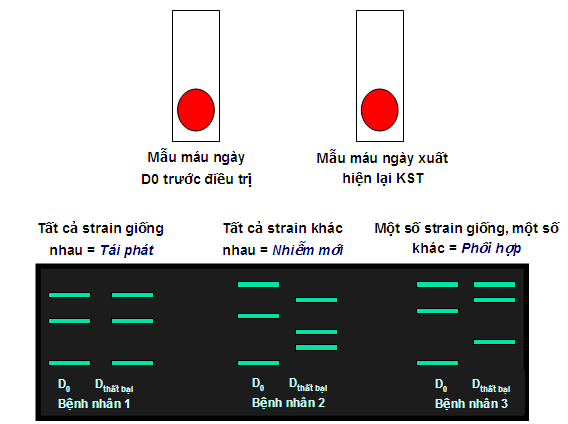
Trong nghiên cứu kháng thuốc là dùng PCR và nested PCR và phân tích giải trình tự, phân tích về mặt gen học của KSTSR, xác định một hay nhiều trường hợp xuất hiện lại KSTSR trong quá trình theo dõi 28/42 ngày là tái phát (recrudescence/ relapse) hay tái nhiễm hay nhiễm mới (reinfection/new infection), thậm chí xác định đột biến phân tử và để xem tỷ lệ thất bại điều trị thật sự của loài P. falciparum hoặc P. vivax với các TSR.
Kỹ thuật này có thể thực hiện hoặc không khi đánh giá P.falciparum ở vùng LHSR từ thấp đến trung bình nhưng bắt buộc phải thực hiện PCR ở vùng lan truyền cao để phân biệt giữa tái phát (cùng dòng KST) và tái nhiễm (khác dòng KST), phân tích kiểu gen dựa trên đa dạng di truyền của những kiểu gen KSTSR như msp1, msp2 và glurp.
Sau đó, các dữ liệu kiểu gen từ các dòng KSTSR trước và sau (D0 và D xuất hiện lại KST) đựơc so sánhtheo từng cặp.
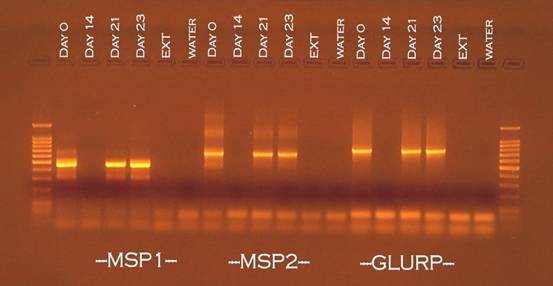 |
| Phân biệt tái phát và tái nhiễm KSTSR dựa trên kỹ thuật PCR |
Đối với bệnh nhân nhiễm P. falciparum
Vì hầu hết các nghiên cứu in vivo được thực hiện tại các vùng LHSR nặng, hoặc rất nặng, nguy cơ lan truyền cao nên cần phân tích PCR để phân biệt giữa tái phát (cùng dòng KSTSR) và tái nhiễm (khác dòng KSTSR), phân tích kiểu gen dựa trên đa dạng di truyền của những kiểu gen KSTSR như SMP1, SMP2 và GLURP (msp1, msp2 và glurp);
Dữ liệu kiểu gen các dòng KSTSR trước và sau đựơc so sánh nhau theo cặp (xem hình). Quy trình lấy mẫu giấy thấm và bảo quản mẫu đến khi thực hiện:
-Lấy 2 - 3 giọt máu vào giấy thấm Whatmann 3mm từ các bệnh nhân đủ tiêu chuẩn nghiên cứu ngay lúc D0. Mẫu thứ 2 được lấy ở thời điểm thất bại điều trị (Dthất bại);
-Các mẫu giấy thấm sẽ được đánh số liệu và ngày theo dõi, bảo quản trong hộp nhựa cá nhân hoặc túi bóng với chất chống ẩm, tránh ánh sáng, độ ẩm và nhiệt độ quá cao, giữ nhiệt độ thường ở thực địa và 40C trong phòng thí nghiệm cho đến khi tách chiết DNA.
-Kỹ thuật PCR được chuyển và phân tích tại la bô sinh học phân tử để phân tích kiểu gen trên những trường hợp thất bại điều trị.
Đối với bệnh nhân nhiễm P. vivax
Vì đây là các vùng LHSR nặng, lan truyền cao đối với bệnh sốt rét nên chúng ta cần phân tích về mặt gen học (như PCR) để phân biệt giữa tái phát (xuất hiện cùng dòng KSTSR) và tái nhiễm (khác dòng KSTSR), song khâu phân biệt giữa tái phát, tái nhiễm đôi khi gặp khó khăn hoặc không thể nếu như nhiễm phải P. vivax phân tích trên lâm sàng và in vivo. Do vậy, chỉ có thể phân tích dựa trên kiểu gen (Chen và cs., 2007; Imwong và cs., 2007). Nghiên cứu thường dựa trên các gen đa hình về di truyền Pvcs và Pvmsp1 (Dao L.D và cs., 2007).
Vì đặc tính và cơ chế tồn tại và tái hoạt thể ngủ trong chu kỳ sinh học P. vivax vẫn chưa thấu đáo. Nên một thách thức khác cho kỹ thuật PCR khi áp dụng cho thử nghiệm đánh giá thử nghiệm thuốc đối với P. vivax là tái phát thật sự gây ra bởi thể ngủ tái hoạt với dòng ký sinh trùng P. vivax tái phát thật sự (nếu cùng dòng) thì không thể xác định hoặc loại trừ được một cách chắc chắn (WHO, 2008).
 |
Phân biệt tái phát và tái nhiễm trên các bệnh nhân xuất hiện KSTSR lại |
Ưu và nhược điểm phương pháp PCR ở nghiên cứu kháng thuốc
Ưu điểm
-Có thể test cùng lúc trên nhiều loại bệnh phẩm (lam, giấy thấm);
-Dễ thu thập mẫu và đơn giản;
-Độ chính xác, độ nhạy và độ đặc hiệu rất cao so với các phương pháp và kỹ thuật khác, nhất là bệnh nhân có mật độ KSTSR dưới ngưỡng phát hiện của KHV (undetectable level);
-Ngưỡng phát hiện cực nhạy của PCR: 0.38-1.35 KST/ µl (P. falciparum) hoặc 0.12 KST/ µl (P. vivax)
-Xác định cùng lúc nhiều loài KSTSR hoặc đồng nhiễm;
-Xác định các hình thái đột biến kháng thuốc do KSTSR.
-Thông tin phân tử trong cơ sở dữ liệu liên kết với kết quả in vivo và in vitro trong nghiên cứu đánh giá kháng thuốc đầy đủ;
-Hệ thống cảnh báo sớm kháng và xác định mô hình toàn cầu về sư xuất hiện và lan rộng kháng cũng như đưa ra mô hình mới cho biết kháng đang gia tăng hay đang giảm;
-Hiệu chỉnh tỷ lệ kháng / thất bại điều trị trên mô hình in vivo trước đó.
Nhược điểm
-Không phù hợp với kết quả hiệu lực trên lâm sàng đầy đủ;
-Không sẵn có các chỉ điểm (marker) cho tất cả các thuốc sốt rét và cả thuốc artemisinine và dẫn suất và ACTs;
-Nhân viên cần có kiến thức cơ bản và phải được đào tạo;
-Kết quả chỉ là hỗ trợ chứ không phải để thay đổi chính sách thuốc.
ĐÁNH GIÁ NHẠY – KHÁNG DỰA VÀO ĐO NỒNG ĐỘ HOẠT CHẤT VÀ CHẤT CHUYỂN HÓA
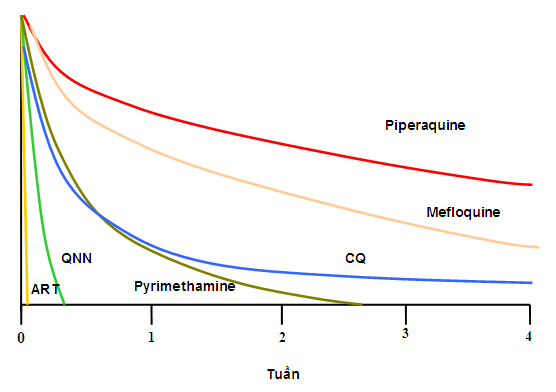
Phương pháp đánh giá nhạy - kháng thuốc CQ của P. vivax dựa vào đo nồng độ thuốc là một phần nghiên cứu lĩnh vực dược động học (nghiên cứu khi một loại thuốc được đưa vào cơ thể sẽ được hấp thu, phân bố, chuyển hóa và đào thải). Lấy máu trên giấy thấm, máu toàn phần hoặc huyết thanh, huyết tương tùy theo mục đích đánh giá và đo nồng độ thuốc hoặc/ và chất chuyển hóa chính của TSR để đánh giá mức độ nhạy - kháng TSR hiện nay là rất phổ biến trong các nghiên cứu dược động học, dược lực học không những đánh giá hiệu lực các phác đồ đang dùng.
Các module của hoạt động về dược học lâm sàng gồm cả thiết kế nghiên cứu dược học, thử nghiệm mẫu và phân tích dược động học và dược lực học của các thuốc sốt rét.
 |
Biểu diễn nồng độ của chloroquine và desethylchloroquine theo thời gian |
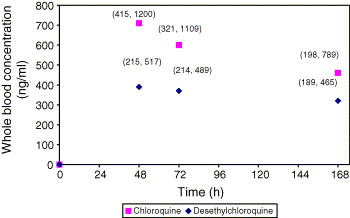
Đo nồng độ thuốc trong máu toàn phần để nhận định kháng
Bình thường, chloroquine ở nồng độ 15ng/ml (trong huyết tương) và 30ng/ml (trong huyết thanh) được xem là nồng độ tối thiểu có hiệu lực ức chế được P. vivax. Trong khi nồng độ thuốc trong máu toàn phần thường cao hơn gấp nhiều lần so với trong huyết thanh và huyết tương.
Ngoài ra, chất chuyển hóa monodesethylchloroquine cũng có thể chống lại P. vivax và nay đã được thừa nhận ngưỡng nhạy của P. vivax với chloroquine theo nồng độ trong máu toàn phần chỉ 70 - 90ng/ml (chloroquine và desethylchloroquine_CQ+DCQ). Do đó, sự có mặt hay tồn tại của KSTSR ở nồng độ thuốc vượt 100ng/ml sẽ được xem là chỉ điểm kháng (lẽ tất nhiên vấn đề này còn lệ thuộc vào nhiều yếu tố khác nữa).
Các bước tiến hành là thường chỉ nên lấy máu ở người trưởng thành trên 15 tuổi với lượng máu chỉ 75-100l (một số nghiên cứu có thể áp dụng trên nhóm đối tượng đặc biệt là phụ nữ mang thai và trẻ em); áp dụng tiến hành các thuốc sốt rét có thời gian bán hủy kéo dài; thời điểm lấy máu có thể D0, D7, D28, ...D42 tùy thuộc vào từng nghiên cứu.
Các trường hợp xuất hiện lại P. vivax, cần đo nồng độ CQ trong máu toàn phần, các mẫu máu được lấy vào giấy thấm Whatman 31ETchr vào các ngày D0, D7, D thất bại và D28. Lấy 75 - 100l máu đầu ngón tay bằng ống mao quản chứa sẵn heparin hoặc chất chống đông EDTA, để khô trong môi trường và bỏ vào túi nhựa plastic có khóa (có thể để được 24 tháng), sau đó gởi đi phân tích bằng máy HPLC (Agilent 1200 series, Agilent technologies, Đức hoặc một số hệ thống sắc ký lỏng cao áp cải tiến thế hệ mới sau này) theo quy trình phương pháp của Bell và cộng sự (2007).
Hệ thống sắc ký lỏng của HPLC sử dụng là cột phân tích trong pha nghịch ZORBAX Ecllpse XDB - C18 (4.6 × 150mm ID, 5 μm), với tốc độ dòng chảy 1ml/phút, pha động isocratic chứa nước đã khử ion, acetonitrile và triethylamine theo tỷ lệ 90%, 10% và 1%.
Cách lấy máu mao mạch để thử nghiệm dược động học
Lấy máu vào tube chống dông
-Ngón tay chuẩn bị lấy máu (thường là lấy ngónnhẫn), phải được rửa sạch, không có vết thương nhiễm trùng nào. Có thể xoa bóp ngón tay trước khi chích máu để tăng tuần hoàn máu dễ lấy hơn;
-Vùng sát trùng để khô trước khi chích máu (tránh pha loãng máu - cồn);
-Bỏ giọt máu đầu (vì chứa những dịch mô làm kết quả không chính xác;
-Lấy máu đầy vào tube 75-100 microlite đã chống đông bằng heparine, EDTA;
-Giữ tube đứng thẳng hơi nghiêng góc so với đầu ngón tay. Máu sẽ chảy ra ngoài ngón hoặc lan ra quanh móng tay là không thích hợp;
-Nếu lượng máu không đủ lên tube có thể xoa bóp nhẹ đầu ngón tay rối vuốt nhẹ từ trên xuống hoặc bóp nhẹ cho máu đi ra. Tránh bóp quá mạnh sẽ tạo dịch mô, không còn tính nguyên vẹn của chất lượng mẫu máu cần lấy đánh giá;
-Dùng tube máu này cho chảy lên tờ giấy thấm (31Etchr, Whatman) làm bằng chất liệu đặc biệt là cotton cellulose bằng cách trút cẩn thận ống máu vào bề mặt giấy thấm;
-Để giấy thấm khô trước khi đem bỏ vào trong túi nhựa. Nếu có gói hút ẩm nên đặt vào trong túi và tránh chạm vào giọt máu;
-Đánh dấu mẫu: ghi thông tin trên mẫu giấy thấm mới lấy máu, thông tin gồm có số hiệu nghiên cứu, thời gian lấy mẫu máu chính xác;
-Vận chuyển mẫu máu đến la bô phân tích thành phần và nồng độ thuốc.
Ưu và nhược điểm đánh giá dược động học hỗ trợ nghiên cứu kháng TSR
-Nghiên cứu về dược học lâm sàng giúp đánh giá nhiều thông số liên quan đến nhạy - kháng thuốc khi liên kết với dữ liệu in vivo, in vitro;
-Xác định nồng độ thuốc có hiệu lực cần thiết;
-Xác định chính xác và chỉ định liều sử dụng tối ưu;
-Độ chính xác / tính phù hợp của thử nghiệm lớn hơn;
-Chỉ định liều tối ưu cho từng loại thuốc sốt rét.
 |
Phân tích về mặt dược động học của một số thuốc sốt rét |
MỘT SỐ PHƯƠNG PHÁP KHÁC HỖ TRỢ ĐÁNH GIÁ KHÁNG THUỐC SỐT RÉT
Gần đây, mạng lưới nghiên cứu kháng thuốc artemisinine trên thế giới (WWARN) đã áp dụng một số phương pháp, kỹ thuật mới hoặc cải tiến từ phương pháp cũ như miễn dịch hấp phụ men (ELISA_Enzyme-Linked Immunosorbent Assays), xác định KSTSR có mặt dựa vào có mặt enzyme pLDH (Lactate De-hydrogenase), hoặc dựa vào phát hiện loại kháng nguyên protein giàu histidine (Histidine-rich protein II_HRP2), thử nghiệm huỳnh quang (FA_Fluorescence-based assays),…
Trong đó, đáng chú ý đến phương pháp đo dòng chảy tế bào hay Fluorometer/ Flow Cytometry:
-Giúp đo sự phát triển của KSTSR thông qua đánh giá sự hấp phụ chất DNA-specific fluorochromes (Sybr Green®);
-Không liên quan đến chất có hoạt tính phóng xạ;
-Đòi hỏi trang thiết bị phòng XN;
-Độ nhạy xác định 0.1%;
-Các vấn đề khác có thể ảnh hưởng do bạch cầu;
-Rất hiệu quả với các dòng clone cho sàng lọc thuốc.
Hoặc đánh giá theo phương pháp phát hiện Isotopic trên in vitro;
-Đo hoạt tính chất chuyển hóa của KST nhờ vào đánh giá tiêu thụ các đầu dò báo hiệu (precursor) đánh dấu chất phóng xạ 3H-labelled hypoxanthine). Phương pháp bán tự động, cho phép xét nghiệm một lượng lớn mẫu trong thời gian ngắn;
-Liên quan đến tiếp xúc chất có hoạt tính phóng xạ nên phải đào tạo nhân viên và an toàn hóa chất;
-Đòi hỏi trang thiết bị đắt tiền;
-Đòi hỏi mật độ KST cao (> 0.2%)
Nhìn chung, các phương pháp và kỹ thuật được giới thiệu ở trên do một số tác giả vận dụng vừa nhằm phát hiện, vừa chẩn đoán và đo mức độ tồn tại KSTSR thông qua sự tồn tại KST, hoặc sản phẩm của chúng, hoặc dựa trên các phản ứng gián tiếp khác nhau hỗ trợ trong các nghiên cứu kháng thuốc.