Hantaviruses thuộc họ Bunyaviridae của virus. Họ Bunyaviridae phân chia thành 5 giống gồm: Orthobunyavirus, Nairovirus, Phlebovirus, Tospovirus, Hantavirus, chúng gồm nhiều loài khác nhau là Tula virus, Andes virus, Bayou virus, Black Creek Canal virus, Cano Delgadito virus, Dobrava-Belgrade virus, El Moro Canyon virus, Hantaan virus, Isla Vista virus, Khabarovsk virus, Laguna Negra virus, Muleshoe virus, New York virus, Prospect Hill virus, Puumala virus, Rio Mamore virus, Rio Segundo virus, Saaremaa virus, Seoul virus, Sin Nombre virus, Thailand virus, Thottapalayam virus, Topografov virus.
Cũng như các thành viên trong họ này, hantaviruses có bộ gen gồm 3 negative-sense, single-stranded RNA segments và vì thế chúng được phân loại như là negative sense RNA viruses. Các virus trong giống Hantavirus là độc nhất lan truyền qua các chất tiết của gặm nhấm trong không khí hoặc qua vết cắn của gặm nhấm, ngược lại tất cả giống khác trong họ Bunyaviridae là virus lây qua đường động vật chân đốt.
Theo phân loại khoa học và nguồn tư liệu y văn ICD-9 là 079.81 và MeSH là D018778. Các loài Andes virus, Amur virus, Azagny virus, Bayou virus, Black Creek Canal virus, Cano Delgadito virus, Calabazo virus, Carrizal virus, Catacamas virus, Choclo virus, Dobrava-Belgrade virus, El Moro Canyon virus, Hantaan virus, Huitzilac virus, Imjin virus, Isla Vista virus, Khabarovsk virus, Laguna Negra virus, Limestone Canyon virus, Magboi virus, Monongahela virus, Montano virus, Mouyassue virus, Muleshoe virus, Muju virus, New York virus, Nova virus, Oran virus, Playa de Oro virus, Prospect Hill virus, Puumala virus, Rio Mamore virus, Rio Segundo virus, Sangassou virus, Saaremaa virus, Seoul virus, Sin Nombre virus, Soochong virus, Tanganya Thailand virus, Thottapalayam virus, Topografov virus, Tula virus
Tên gọi Hantavirus bắt nguồn từ con sông Hantan, nơi mà các virus Hantaan (bệnh sinh của loại bệnh sốt xuất huyết Hàn Quốc) lần đầu tiên được phân lập bởi tiến sĩ Ho-Wang Lee và cộng sự. Bệnh này liên quan đến virus Hantaan gọi là sốt xuất huyết kèm theo hội chứng thận (hemorrhagic fever with renal syndrome_HFRS), một thuật ngữ được chấp nhận bởi Tổ chức y tế thế giới (WHO). Tên gọi kinh điển trước đây là “Korean hemorrhagic fever” (sốt xuất huyết Hàn Quốc) từ lâu không còn được sử dụng nữa.
Một số thuật ngữ mô tả thể bệnh do Hantavirus ở người như Hội chứng phổi do Hantavirus (HPS_Hantavirus pulmonary syndrome) hoặc Hội chứng sốt xuất huyết thể thận do Hantavirus (tên tiếng Anh là HFRS_Hemorrhagic fever with renal syndrome hoặc tên tiếng Pháp là Fièvre hémorragique avec syndrome rénal_FHSR) hay một số tác giả khác gọi Fièvre hémorragique de Corée, Néphropathie épidémique, …
Tuy nhiên, tên gọi hiện nay giới chuyên môn chỉ tập trung vào hai thể bệnh HPS và HFRS.
Virus từ chuột gây suy thận “hoành hành” trên thế giới và Việt Nam
Ngày 21-11, Trung tâm Kiểm soát và phòng bệnh Mỹ (CDC) thông báo vừa có thêm một người nhiễm virus Hanta do chuột cắn. Như vậy, tính đến nay nước Mỹ đã có 3 người chết vì và 10 người nhiễm bệnh do virus lây truyền từ chuột. Đợt xuất hiện gần nhất là vào mùa hè năm nay tại Công viên Quốc gia Yosemite, California (Mỹ). Theo ước tính, khoảng 10.000 người có nguy cơ bị hội chứng viêm phổi do nhiễm virus Hanta trong khoảng thời gian từ tháng 6 đến tháng 8 vừa qua, trong số này có 2.500 du khách nước ngoài. Vì vậy, giới chức y tế Mỹ đã gửi thông báo cho 39 quốc gia, phần lớn thuộc Liên hiệp châu Âu, cho biết những công dân đã sống trong các lều cách nhiệt thuộc làng Curry của Yosemite vào mùa hè này có thể đã bị nhiễm Hantavirus từ chuột nai. Đây là loài chuột mang virus Hanta rất phổ biến ở Châu Mỹ.
Nạn nhân đầu tiên của Mỹ năm nay là một người đàn ông 37 tuổi ở quận Alameda Couty (California) - đã qua đời hồi cuối tháng 7. Nạn nhân thứ 3 tử vong là người đàn ông đến từ Tây Virginia - một trong những du khách đã đến thăm công viên quốc gia Yosemite. Trước thực trạng trên, Tiến sĩ Rahul Gupta, Giám đốc Sở Y tế Kanawha - Charleston phải lên tiếng trấn an người dân: “Mọi người không nên quá hoang mang. Đây không phải là một căn bệnh phổ biến”.
 |
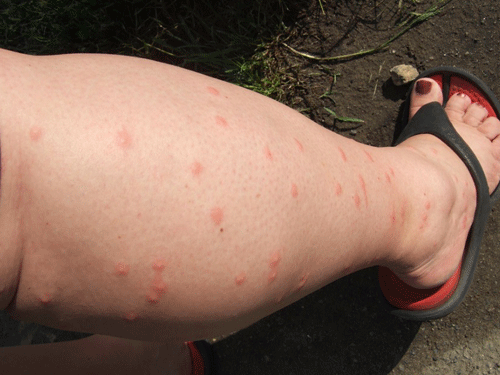 |
Vết cắn do chuột nai ở Châu Mỹ gây ra |
Tuy nhiên, theo thông kê đến năm 2011của CDC, có tổng cộng 602 người nhiễm virus Hanta, riêng ở Mỹ có tới 587 trường hợp ở 34 tiểu bang. Trong đó, có 556 ca xảy ra trong hoặc sau đợt bùng nổ dịch bệnh này lần đầu tiên vào năm 1993 ở khu vực “Ngã tư” (Four Corners) miền Tây Nam nước Mỹ. Đợt dịch này đã giết chết ít nhất 26 người, 3/4 nạn nhân là sống ở nông thôn.
Virus Hanta được truyền qua người từ đường chuột cắn hoặc phân và nước tiểu của chúng. Hầu hết các nạn nhân nhiễm virus Hanta thường xuất hiện các triệu chứng đầu tiên giống như cảm cúm, gồm sốt, nhức đầu, đau cơ bắp, thường ở đùi, lưng và hông. Sau 2-7 ngày, nhiều bệnh nhân có biểu hiện suy hô hấp, suy thận, 1/3 số người nhiễm bệnh có thể tử vong.
Hiện chưa có phương pháp điều trị cụ thể đối với những trường hợp nhiễm virus Hanta. Theo các quan chức y tế, đây là căn bệnh hiếm gặp và khó chẩn đoán. Vì vậy, các bác sĩ khuyến cáo mọi người nên tránh xa những loài gặm nhấm mang mầm bệnh, đặc biệt là những con chuột cống lông ướt và run rẩy, vì đa số chúng mang trong mình virus chết người.
Tổng quan về loại tác nhân gây bệnh Hantavirus
Bệnh do hantavirus gây ra có 2 thể với tên gọi là hội chứng phổi do Hantavirus (HPS_Hantavirus pulmonary syndrome) hoặc Hội chứng sốt xuất huyết thể thận do Hantavirus (HFRS_Hemorrhagic fever with renal syndrome). Đây là một bệnh thường lan rộng do các loài gặm nhấm truyền bệnh và biểu hiện triệu chứng giống cúm.
Lịch sử của bệnh do Hantavirus
Loại Hantavirus có lẽ là một trong những khám phá tương đối mới với giống virus, toàn bộ bệnh HFRS lần đầu tiên đựợc nhận ra bởi tác giả tiến sĩ Lee Ho Wang- một người làm công tác tây y trong suốt thời gian chiến tranh Hàn Quốc vào những năm đầu 1950. Năm 1993, các loài mới của hantavirus được tìm thấy sau hội chứng tim phổi do Hantavirus (Hantavirus cardiopulmonary syndrome_HCPS hay cũng có thể gọi HPS) gây ra bởi virus Sin Nombre (tiếngTây Ban Nha thì virus Sin nombre có nghĩa là virus vô danh) tại New Mexico và 4 bang. Các vật chủ gặm nhấm của chúng lần đầu tiên xác định bởi Terry Yates, một giáo sư tại đại học New Mexico. Ngoài các Hantaan virus và Sin Nombre virus, một số loại Hantaviruses khác đã được làm rõ vai trò bệnh sinh đối với HFRS hoặc HCPS.
Hantavirus được đề cập đến lần đầu tiên năm 1951 nhân dịch bệnh xảy ra cho quân đội Mỹ đang tham chiến tại Hàn Quốc. Ca đầu tiên bệnh do Hantavirus được ghi nhận tại Mỹ vào năm 1970, tại Canada năm 1990 và vào năm 1993 dịch bệnh Hantavirus được thấy xuất hiện tại Bỉ và miền Tây Nam Hoa Kỳ. Ở loài gặm nhấm nói chung và loài chuột nói riêng, sự lây nhiễm có thể xảy ra theo lối “transmission horizontale” có nghĩa là từ con này lây sang con khác. Chuột và loài gặm nhấm được xem là ổ chứa Hantavirus. Chúng không biểu hiện ra thành bệnh (asymptomatique) nhưng có thể tiết virus qua nước bọt, nước tiểu và phân. Gia súc có thể mang kháng thể (séro convertir) nhưng không có dấu hiệu nào cho thấy có biểu hiện ra thành bệnh hoặc tiết Hantavirus ra ngoài.
Về mặt virus học của Hantavirus
Bộ gen
Cũng như các thành viên trong họ virus Bunyavirus, thì Hantavirus là loại virus có vỏ bọc (enveloped viruses) với bộ gen bao gồm 3 bộ phận single-stranded, negative sense RNA segments designated S (small), M (medium), L (large). Các S RNA mã hóa cho nucleocapsid (N) protein. Loại M RNA mã hóa cho một loại polyprotein có liên quan đến quá trình “envelope” glycoproteins G1 và G2. Loại L RNA mã hóa cho L protein, các chức năng này tựa như chức năng sao chépcủa virus (viral transcriptase/replicase). Bên trong các virion, RNAs của bộ gen của virus Hanta được xem là phức tạp với N protein để hình thành các nucleocapsid xoắn, các thành phần RNA lưu hành do bổ sung trình từ giữa trình tự chuỗi 5' và 3' của các đoạn trong bộ gen.
Đường vào của virus vào các tế bào vật chủ thông qua dính kết của các virion với các tiếp thụ thể của tế bào và chương trình nội thực bào. Nucleocapsids đi vào trong bào tương nhờ vào cầu nối lệ thuộc độ pH của virion với màng endosomal. Sau đó ly giải nucleocapsid vào trong bào tương, phức hợp tiếp đích với các thành phần ER-Golgi Intermediate compartments (ERGIC) thông qua cơ chế chuyển động có liên quan đến vi quản dẫn đến hình thành các “nhà máy” virus tại ERGIC. Rồi các nhà máy này hỗ trợ cho quá trình sao chép và phiên mã của các protein của virus. Sự sao chép của các gen virus phải được khởi đầu nhờ liên quan đến L protein với 3 loài nucleocapsid.
Ngoài sự sao chép và chức năng nhân lên, L protein của virus cũng có hoạt động của endonuclease là phân tích các thông tin tế bào RNAs (mRNAs) cho quá trình sinh sản của các cặp mồi dùng để khởi động cho quá trình sao chép của mRNAs virus. Vì nhờ sự bắt dính ("cap snatching,"), các mRNAs của hantavirus được bao lấy và chứa các đoạn kéo dài nontemplated 5' terminal. Phần G1 (aka Gn) và G2 (Gc) glycoproteins ở dạng hetero-oligomers và chuyển từ lưới nọi mô sang phức hợp Golgi, ở đó quá trình glycosyl hóa hoàn thành.
Các L protein sinh ra các bộ gen mới (nascent genomes) nhờ sự sao chép thông qua một trung gian positive-sense RNA. Hantavirus virions được xem là có gắn kết bởi liên kết của các nucleocapsids với glycoprotein ôm lấy màng của của bộ Golgi, theo sau bởi túi Golgi. Tiếp đến, các virion mới sinh chuyển vào trong các túi dịch tiết với màng bào tương và ly giải bởi quá trình đào thải khỏi tế bào.
Virions
Hantavirus virions có đường kính khoảng 100 nm. Một lớp kép lipid bọc ngoiaf của virus khoảng dày 5nm và dính liền với các protein bề mặt, mà đường tồn lưu dính vào tại nơi đó. Cácglycoprotein này được biết là G1 và G2, mã hóa bởi phần M của bộ gen virus. Chúng có xu hướng liên kết (heterodimerize) với mỗi cái khác và cả hai đuôi trước và domain ngoài kéo dài 6nm về phía sau bề mặt. Bên trong lớp vỏ bọc là các nucleocapsids. Đây là các thành phần của nhiều bản sao của nucleocapsid protein N, mà nó tương tác với 3 đoạn của bộ gen virus để hình thành nên cấu trúc xoắn. Tiến trình tổng hợp RNA mã hóa cũng được tìm thấy trong phần bên trong. Theo hàng loạt như thế, các virion lớn hơn 50% protein, 20-30% lipid và 2-7% carbohydrate. Tỷ trọng của virions là 1.18 gram/cm3. Các đặc điểm này thường cho tất cả thành viên của học Bunyaviridae.
Vũ khí sinh học
Sốt xuất huyết Hàn Quốc do Hantavirus là một trong 3 bệnh sốt xuất huyết và là một trong nhiều tác nhân gây bệnh tại Mỹ được nghiên cứu như là một tác nhân vũ khí sinh học tiềm năng (potential biological weapons) trước khi dừng lại chương trình vũ khí sinh học.
Chu kỳ sinh học
Đường vào trong các tế bào vật chủ được nghĩ xảy ra bởi sự kết dính của các virions với các receptor tế bào và quá trình thực ẩm bào (endocytosis) tiếp theo đó. Các nucleocapsid được xem đi vào các cytoplasm nhờ vào cầu nối lệ thuộc pH của virion với màng endosomal. Theo sau quá trình ly giải của các nucleocapsid vào trong cytoplasm, phức hợp được đích hướng đến ER-Golgi Intermediate compartments (ERGIC) thông qua các ống vi quản liên kết với sự chuyển động dẫn đến hình thành nhà máy virus tại ERGIC.
Các nhà máy này rồi sẽ hỗ trợ cho sự sao chép và chuyển dịch mã tiếp theo của các protein virus. Sự chuyển mã của các gen virus phải được khởi động bởi sự kết hợp của L protein với 3 loại nucleocapsid. Bên cạnh chức năng chuyển và nhân lên, các protein L của virus cũng được xem là có hoạt tính endonuclease mà cleabám chặt vào các thông tin tế bào RNAs (mRNAs) đối với sự sinh sản các mooid bắt cặp sử dụng để khởi động cho quá trình sao mã của mRNAs virus. Như một kết quả của quá trình bắt “cap snatching," thì các mRNAs của hantaviruses bị bắt và chứa các đoạn kéo dài tận cùng của 5'..
Thể G1 (aka Gn) và G2 (Gc) glycoprotein là hetero-oligomersvà chuyển dịch từ tế bào lưới nội mô đến phức bộ Golgi, ở đó quá trình hình thành glycosylationhóa hoàn thành. L protein sinh ra một bộ gen mới sinh do sự sao chép nhân lên thông qua một trung gian positive-sense RNA. Các virions của Hantavirus được xem là gắn kết của nucleocapsid với glycoproteins với nhau trong các màng của Golgi, theo sau bởi sự bắt đầu phát sinh thành túi đựng dịch Golgi.Các virion túi đựng dịch được chuyển trong một túi tiết đến màng bào tương và ly giải bởi sự ngoại tiết.
Cơ chế bệnh sinh do virus Hanta
Bệnh sinh của nhiễm trùng virus Hantavirus đến nay vẫn chưa rõ ràng vì thiếu các dữ liệu trên mô hình thực nghiệm (các con chuột dường như không mắc bệnh nghiêm trọng).
Trong khi vị trí sao chép của virus đầu tiên chưa rõ, cả thể HFRS và HPS, thì tác động chính của chúng là trên mạch máu, trong khi HPS có triệu chứng hầu hết có liên quan đến phổi. Trong thể HFRS, có một sự gia tăng tính thấm thành mạch và hạ huyết áp do rối loạn chức năng tế bào nội mô, tổn thương đáng kể nhất nhìn thấy trong tạng thận. Ngược lại với thể HPS thì tạng phổi, lách và túi mật bị ảnh hưởng nhiều nhất. Các triệu chứng sớm của HPS có hình thái lâm sàng giống như bệnh cúm (đau cơ, sốt, nhức đầu và suy nhược) và thường khoảng 2-3 tuần sau khi phơi nhiễm phát bệnh. Những giai đoạn sau đó của bệnh (khoảng 4 - 10 ngày sau kể từ khi triệu chứng khởi phát) sẽ bao gồm khó thở, ho,…
Quá trình tiến hóa của virus Hanta
Phát hiện ra sự phù hợp có ý nghĩa giữa phylogenies của hantaviruses và phylogenies của ổ chức các loài gặm nhấm đưa đến một giả thuyết – chấp nhận cao cho đến gần đây – sự song hành cùng tiến hóa trên nền tảng lâu dài của vật chủ loài gặm nhấm với các virus Hanta. Tuy nhiên,các phát minh gần đây đưa các nhà khoa học bàn luận và đưa ra giả thuyết mới liên quan đến tiến hóa của virus Hanta.
Các virus Hanta khác nhau đã đươc tìm thấy có nhiễm trên nhiều loài gặm nhấm và các ca lan truyền chéo loài (cross-species transmission-host switching) đã được ghi nhận. Thêm vào đó, tỷ lệ thay thế dựa trên dữ liệu về trình tự nucleotide thể hiện mà các nhánh hantavirus và dưới họ của loài gặm nhấm không thể phân tán đồng thời. Ngoài ra, hantaviruses đã được tìm thấy trên nhiều loài chuột chù và chuột chũi.
Giải thích về sự trái ngược trong quá trình đồng tiến hóa ở giả thuyết này, Ramsden và cộng sự (2009) đã đề nghị rằng mô hình nhìn thấy ở hantaviruses trong mối lien quan với các ở chứa của chúng có thể góp phần ưu thế cho chuyển dịch sang vật chủ khác bởi trạng thái ở gần về mặt địa lý và sự thích nghi với các loại vật chủ đặc hiệu. Ulrich và cộng sự (2010) đã đè nghị rằng các chùm trình tự virus liên quan trên diện mặt địa lý đã nghiên cứu có thể gây ra bởi một cơ chế xa do phân lập. Trên cơ sở so sánh các hanta virus được tìm thấy trên các vật chủ thuộc bộ Rodentia vàSoricomorpha, Yanagihara và cộng sự (2011) đã đưa ra rằng lịch sử tiến hóa của hantavirus gồm có một phức hợp gồm cả chuyển dịch vật chủ và cùng tiến hóa mà trong đó tổ tiên của chuột chũi và chuột cống hơn các loài gặm nhấm khác đã được xem xét coi như chứa các hantavirus cổ xưa.
Một số đặc điểm về dịch tễ học virus Hanta trên thế giới
Nguyên nhân, tỷ lệ và các yếu tố nguy cơ
Hantavirus có thể gây bệnh cho người trong nhiều năm qua tại Mỹ, nhưng không được nhận ra mãi cho đến thời gian gần đây. Năm 1993, một vụ dịch gây suy hô hấp tử vong trên các vùng đất dành riêng cho người Ấn ở biên giới Utah, Colorado, New Mexico, Arizona. Các nhà nghiên cứu đã khám phá ra rằng Hantavirus gây ra dịch. Từ sự khám phá này, bệnh do Hantavirus đã được báo cáo mỗi bang phía tây và nhiều bang ở phía đông.
Hantavirus được mang bởi các loài gặm nhấm, đặc biệt là chuột chân trắng. Virus trong nước tiểu và trong phân của chuột nhưng không làm cho động vật mang mầm bệnh bị đau (đó là điều đặc biệt). Người trở nên bị nhiễm khi họ phơi nhiễm với các chất thải nhiễm từ chuột hoặc vật tiết. Bệnh không lây truyền từ người sang người, nhiều người có thể nhiễm đồng thời sẽ giải thích cho vấn đề cùng phơi nhiễm với các vùng có các chất nhiễm
Trung tâm phòng chống bệnh tật của Mỹ (The U.S. Centers for Disease Control and Prevention_US.CDC) báo cáo các loài gặm nhấm mang Hantavirus đã được tìm thấy ít nhất tại 20 công viên. CDC nói rằng có khả năng virus hiện đang có mặt ở tất cả công viên không chừng. CDC nghi ngờ các người đi căm trại hoặc đi bộ đường dài có thể mắc bệnh hơn các người khác vì họ thường liên quan đến các khu rừng và nằm ngủ trong các chiếc túi ngủ,…Tuy nhiên, có một vài trường hợp có liên quan trực tiếp đến cắm trại và đi bộ xa. Hầu hết người tiếp xúc với virus khi họ tiếp xúc với các giọt hay vật phẩm nhiễm của gặm nhấm.
Bệnh thường lây từ chuột sang người qua đường hô hấp, từ những giọt khí dung nước tiểu chuột, chứ hiếm khi lây do chuột cắn người. Nếu bước vào những nhà kho bỏ hoang lâu ngày, nhầy nhụa, có chuột sinh sống và phóng uế nhiều, người ta rất dễ nhiễm virút Hanta.
Phân bố tại các vùng/ khu vực khác nhau (số liệu cập nhật đến năm 2012)
Các vùng đặc biệt bị nhiễm bởi hội chứng HFRS gồm có Trung Quốc, đảo Hàn Quốc, Nga, (tên gọi Hantaan, Puumala và Seoul viruses), và ở khu vực bắc và tây Âu (tên gọi Puumalavà Dobrava virus). Các vùng có tỷ lệ mắc mới cao nhất của hội chứng HCPS gồm Patagonian Argentina, Chile, Brazil, Mỹ, Canada và Panama, nơi mà có thể nhẹ hơn của bệnh ở tim mạch đã được nhận ra.
Nam Mỹ
Hai tác nhân của HCPS tại Nam Mỹ là virus Andes (còn gọi là Oran, Castelo de Sonhos, Lechiguanas, Juquitiba, Araraquara và Bermejo viruses), trong số nhiều thuật ngữ đồng nghĩa khác, nhưng virus Hantavirus vẫn là hay dùng nhất một thể lan truyền giữa các nhân với nhau và virus Laguna Negra, một loại có liên quan rất chặt chẽ với một loại virus được biết trước đó - Rio Mamore virus. Các loại gặm nhấm đã cho thấy có mang Hantavirus gồm chuột Abrothrix longipilis và Oligoryzomys longicaudatus.
Bắc Mỹ
Tại Mỹ, một số ca nhẹ của HCPS gồm có New York virus, Bayou virus và có thể loại BlackCreek Canal virus. Tại Mỹ, trong tháng 7.2010 có đến 8 bang báo cáo có hơn 30 ca Hantavirus từ năm 1993: New Mexico (84), Colorado (70), Arizona (62), California (42), Washington (41), Texas (37), Utah (31) và Montana (30). Các bang khác đang báo cáo một lượng đáng kể số ca gồm Idaho (16), Kansas (15), South Dakota (15), North Dakota (12) và Oregon. Cuối tháng 8 và đầu tháng 9 năm 2012, có 8 ca mới của Hantavirus được xác định, gồm có 3 ca tử vong tại vùng Curry Village của công viên Yosemite National Park.
Ngoài các loài gặm nhấm nhiễm virus hantaviruses được biết có mang bởi các động vật thuộc bộ gặm nhấm (bộ Soricomorpha, họ Soricidae) và chuột chũi (họ Talpidae). Tại Mexico một số gặm nhấm đã được tìm thấy có mang hantavirus: Megadontomys thomasi, Neotoma picta, Peromyscus beatae, Reithrodontomys megalotis và Reithrodontomys sumichrasti.
Châu Âu
Tại châu Âu có 3 loại hantavirus: Puumala, Dobrava và Saaremaa virus được biết là nguyên nhân gây nên sốt xuất huyết với hội chứng thận. Puumala thường gây nên bệnh lý với thể bệnh nhẹ - bệnh lý thận có yếu tố dịch tễ học (nephropathia epidemica) biểu hiện điển hình là sốt, đau đầu, hội chứng tiêu hóa, suy giảm chức năng thận và nhìn mờ hay giảm thị lực. Nhiễm trùng với Dobrava thường giống các biến chứng xuất huyết. Có một số báo cáo xác định nhiễm Saaremaa nhưng nhiễm trùng này dường như tương tự những ca gây ra bởi Puumala và ít biểu hiện bệnh sinh hơn Dobrava.
Puumala được mang bởi các vật chủ là loài gặm nhấm, loại chuột đồng (Clethrionomys glareolus) và hầu hết có mặt tại khắp châu Âu ngoại trừ vùng Trung Đông. Dobrava và Saaremaa được mang bởi lần lượt con chuột cổ vàng (Apodemus flavicollis) và chuột đồng có sọc vằn (Apodemus agrarius) được báo cáo chủ yếu tại Đông và Trung Âu.
Châu Phi
Một loại hantavirus (Sangassou virus) đã được phân lập tại châu Phi.
Tỷ lệ mắc bệnh
Chuột Sigmodon hispidus là một loài gặm nhấm mang Hantavirus và là mối đe dọa khi chúng đi vào các vùng sống và sinh hoạt của con người tại nôn thôn và ngoại ô.
Các vùng đặc biệt bị ảnh hưởng bởi HFRS gồm Trung Quốc, Hàn Quốc, Nga (Hantaan, Puumala và Seoul virus) và bắc Âu cũng như Tây Âu (Puumala và Dobrava virus). Các vùng có tỷ lệ mắc mới cao nhất của HCPS gồm có Patagonian Argentina, Chile, Brazil, Mỹ, Canada, Panama, nơi có một thể nhẹ hơn của bệnh trên tim đã được xác định. Hai tác nhân của HCPS ở phía Nam Mỹ là Andes virus (còn gọi là Oran, Castelo de Sonhos, Lechiguanas, Juquitiba, Araraquara, Bermejo virus, trong số này có nhiều thuật ngữ đồng nghĩa khác), chỉ có Hantavirus cho thấy lây nhiễm từ người sang người (!?) và virus Laguna Negra có liên quan chặt chẽ với virus Rio Mamore đã được biết trước đây. Tại Mỹ, một số ít ca HCPS gồm các loại virus như New York virus, Bayou virus, và có thể Black Creek Canal virus.
Đến tháng 7.2007 có 6 bang báo cáo nhiễm Hantavirus kể từ năm 1993: New Mexico (69), Colorado (49), Arizona (46), California (43), Texas (33) và Washington (31). Các bang khác đang báo cáo với một số ca có ý nghĩa gồm có Montana (25), Idaho (19) và Utah (24). Với chỉ 7 ca, Oregon có tỷ lệ nhiễm bệnh thấp hơn có ý nghĩa trong tất cả và liên quan đến quần thể, so vớicác bang ở phía Tây.
Tài liệu tham khảo
1.Araki K., Yoshimatsu K., Ogino M., Ebihara H., Lundkvist A., Kariwa H., Takashima I., Arikawa J. (2001). Truncated hantavirus nucleocapsid proteins for serotyping Hantaan, Seoul, and Dobrava hantavirus infections. J Clin Microbiol, 39: 2397–2404.
2.Ho Wang Lee, Charles Calisher, Connie Schmaljohn (1998). Manual of Hemorrhagic Fever with Renal Syndrome and Hantanvirus Pulmonary Syndrome. WHO Collaborating Center for Virus Reference and Reseach (Hantanviruses) Asian Institute for Life Sciences, Seoul, 18–33.
3.James Chin, MD, MHP, Editor (2000). Control of Communicable Disease Manual. 17th APHA. ICD-9 078.6; ICD10 A98.5: 231-235.
4.Knap Jp. et al. (2006). A case of haemorrhagic fever with renal syndrome. Pol Merkur Lekarski, 21: 474-476.
5.Miyamoto H., Kariwa H., Araki K., Lokugamage K., Hayasaka D., Cui B.Z., Lokugamage N., Ivanov L.I., Mizutani T., Iwasa
6.M.A., Yoshimatsu K., Arikawa J., Takashima I. (2003). Serological analysis of hemorrhagic fever with renal syndrome (HFRS) patients in Far Eastern Russia and identification of the causative hantavirus genotype. Arch Virol, 148: 1543–1556.
7.Vu Thi Que Huong, Kumiko Yoshimatsu, Vu Dinh Luan, Le Van Tuan, Le Nhi, Jiro Arikawa, and Tran Minh Nhu Nguyen (2010). Hemorrhagic Fever with Renal Syndrome, Vietnam. Emerging Infectious Diseases, www.cdc.gov/eid, 16(2): 363-365.
8.William Morris, Molly Fainstat, Tracey Robinson, Robert Hoo (1994). Hemorrhagic Fever with Renal Syndrome in California. WJW, 161(4): 418-421.
9.Yoshimatsu K., Arikawa J., Yoshida R., Li H., Yoo Y.-C., Kariwa K., Hashimoto N., Kakinuma M., Nobunaga T., Azuma I. (1995). Production of recombinant hantavirus nucleocapsid protein expressed in silkworm larvae and its use as a diagnostic antigen in detecting antibodies in serum from infected rats. Lab Anim Sci, 45: 641–646.
10.Zhenqiang Bi, Pierre B.H. Formenty, Cathy E. Roth (2008). Hantavirus Infection: a review and global update. J Infect Developing Countries, 2(1): 3-23.
11.Zuo S.Q., Zhang P.H., Jiang J.F., Zhan L., Wu X.M., Zhao W.J., et al. (2008). Seoul virus in patients and rodents from Beijing, China. Am J Trop Med Hyg, 78: 833–837.
12.http://www.cdc.gov/ncidod/diseases/hanta/hps/
13.Nationally notifiable conditions. Annual lists of infectious conditions. Available at: http://www.cdc.gov/ncphi/disss/nndss/phs/infdis.htm. Accessed December 21, 2009.
14.Mertz GJ, Hjelle B, Crowley M, Iwamoto G, Tomicic V, Vial PA. Diagnosis and treatment of new world hantavirus infections. Curr Opin Infect Dis 2006;19:437--42.
15.Koster F, Foucar K, Hjelle B, et al. Rapid presumptive diagnosis of hantavirus cardiopulmonary syndrome by peripheral blood smear review. Am J Clin Pathol 2001;116:665--72.
16.Khan AS, Khabbaz RF, Armstrong LR, et al. Hantavirus pulmonary syndrome: the first 100 US cases. J Infect Dis 1996;173:1297--303.
17.Ramos MM, Overturf GD, Crowley MR, Rosenberg RB, Hjelle B. Infection with Sin Nombre hantavirus: clinical presentation and outcome in children and adolescents. Pediatrics 2001;108:e27.
18.Mertz GJ, Miedzinski L, Goade D. Placebo-controlled, double-blind trial of intravenous ribavirin for the treatment of hantavirus cardiopulmonary syndrome in North America. Clin Infect Dis 2004;39:1307--13.
19.Hallin GW, Simpson SQ, Crowell RE, et al. Cardiopulmonary manifestations of hantavirus pulmonary syndrome. Crit Care Med 1996;24:252--8.
20.Dietl CA, Wernle JA, Pett SB, et al. Extracorporeal membrane oxygenation support improves survival of patients with severe hantavirus cardiopulmonary syndrome. J Thorac Cardiovasc Surg 2008;135:579--84.
21.St Jeor S. Three-week incubation period for hantavirus infection. Pediatr Infect Dis J 2004;23:974-5.
22.Bell M. Viral hemorrhagic fevers. In: Goldman L, Ausiello D, eds. Cecil Medicine. 23rd ed. Philadelphia, Pa: Saunders Elsevier;2007:chap 404.
23.CDC. Hantavirus pulmonary syndrome-United States: updated recommendations for risk reduction. MMWR 2002;51(No. RR-9).
24.Martinez, V. P.; Bellomo, C.; San Juan, J.; Pinna, D.; Forlenza, R.; Elder, M.; Padula, P. J. (2005). "Person-to-person transmission of Andes virus". Emerging Infectious Diseases 11 (12): 1848–1853.
25.Lee, HW, Johnson, KM (1978). "Isolation of the etiologic agent of Korean Hemorrhagic fever". The Journal of infectious diseases 137 (3): 298–308.
26.Jonsson, C. B.; Figueiredo, L. T. M.; Vapalahti, O. (2010). "A Global Perspective on Hantavirus Ecology, Epidemiology, and Disease". Clinical Microbiology Reviews 23 (2): 412–441.
27.Thwaites, Guy; Taviner, Mark; Gant, Vanya (1997). "The English Sweating Sickness, 1485 to 1551". New England Journal of Medicine 336 (8): 580–582.
28.M. Taviner, G. Thwaites, and V. Gant (1998). "The English sweating sickness, 1485-1551: a viral pulmonary disease?". Medical History (Department of Modern History. St Andrews University, London) 42 (1): 96–98.
29.Bridson, Eric (2001). "English 'sweate' (Sudor Anglicus) and Hantavirus pulmonary syndrome, The". British Journal of Biomedical Science.
30.Padula, P; Edelstein A, Miguel SD, López NM, Rossi CM, Rabinovich RD. (February 15, 1998). "Hantavirus pulmonary syndrome outbreak in Argentina: molecular evidence for person-to-person transmission of Andes virus". Virology (London: Elsevier) 241 (2): 323–330.
31.Schudel, Matt (2007-12-24). "Terry Yates, 57; biologist found source of hantavirus". Washington Post (Boston Globe).
32."Hantavirus: Canadian Lung Association". Canadian Lung Association. 18 August 2009. Retrieved 17 March 2011.
33.Medina RA, Torres-Perez F, Galeno H, Navarrete M, Vial PA, Palma RE, Ferres M, Cook JA, Hjelle B (2009) Ecology, genetic diversity, and phylogeographic structure of andes virus in humans and rodents in Chile. J Virol 83(6):2446-2459.