Thời gian gần đây nhiều ứng viên thuốc chống sốt rét mới đang trong nghiên cứu tiền lâm sàng (Pre-clinical studies) hay các giai đoạn thử nghiệm lâm sàng (phases of clinical trials) I-III, trong khi ở Tiểu vùng sông Mê Kông (GMS) P.falciparum kháng Artemisinine, có nguy cơ kháng cả trị liệu phối hợp thuốc này (ACTs)-loại thuốc đầu tay (first line) thay thế đơn trị liệu Artemisinine/Artesunate đường uống. Do đó nhu cầu thuốc sốt rét mới trở nên cấp thiết nhưng để có một loại thuốc mới cần một quá trình thử nghiệm rất dài, đôi khi vài năm hoặc lâu hơn.
Nhu cầu thuốc chống sốt rét mới
Theo Tổ chức Y tế thế giới (WHO), Việt Nam là 1 trong 4 quốc gia GMS có tỷ lệ kháng Artemisinine ngày càng phức tạp bao gồm Việt Nam, Thái Lan, Myanma và Campuchia. Tại Việt Nam, WHO xác định 5 tỉnh có ký sinh trùng sốt rétP.falciparumkháng Artemisinine bao gồm Bình Phước, Đắk Nông, Gia Lai, Quảng Nam và Khánh Hòa; trong đó tỉnh Bình Phước được phát hiện kháng với thuốc này lần đầu tiên vào năm 2009. Các kết quả nghiên cứu cho thấy tỷ lệ tồn tại KSTSR ngày thứ 3 điều trị (D3) cao trở ngại cho việc điều trị sốt rét, nhất là sốt rét ác tính vì đây là loại thuốc có hiệu lực cao với chủng ký sinh trùng này do đó nhu cầu về thuốc điều trị sốt rét mới trở nên khẩn thiết hơn bao giờ hết trên lộ trình loại trừ sốt rét vào năm 2030. Đểkhắc phục tình trạng kháng artemisinine,các nhà nghiên cứu đã tiến hành các thử nghiệm phân biệt chủng P.falciparum kháng hay nhạy cảm với artemisinin trong 3 ngày đầu điều trịnhằm cung cấp ưu thế nhanh và ít tốn kém hơn các thử nghiệm đáp ứng thuốc thông thường bằng cách cho ký sinh trùng non tiếp xúc với atermisinin liều cao trong thời gian ngắn giống như cách chúng tiếp xúc với thuốc trên các bệnh nhân đã được điều trị sốt rét và sự tồn tại của chúng được đếm sau 72 giờ.
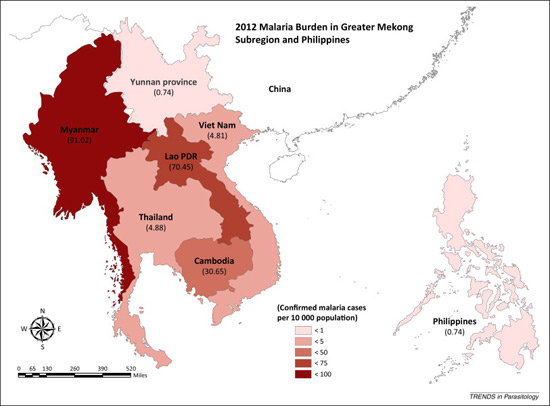
Nguy cơ sốt rét kháng artemisinine và trị liệu phối hợp ACTs lan rộng GMS và toàn cầu
Một giải pháp khác là sử dụng artemisinine dưới dạng phối hợp (ACTs) để bảo vệ thuốc không bị ký sinh trùng phát triển kháng trong bối cảnh dòng ký sinh trùng kháng artemisinin có nguy cơ lan rộng toàn GMS, kế cả châu Phi.Trị liệu phối hợp này được dùng điều trị tuyến đầu (first line treatment) với sốt rét do P.falciparum chưa biến chứng (uncomplicated malaria) làm giảm khả năng phát triển kháng thuốc, đồng thời làm sạch ký sinh trùng khỏi cơ thể. WHO khuyến cáo ACTs là trị liệu hàng đầu với sốt rét do P.falciparum chưa biến chứng đã góp phần tích cực làm giảm tử vong sốt rét toàn cầu những năm qua. Tuy nhiên, P.falciparum có khả năng thích nghi với trị liệu phối hợp này trong quá trình sử dụng nên nguy cơ chủng ký sinh trùng này giảm hiệu lực với ACTs đang trở nên hiện hữu song hành với kháng artemisinin, đe dọa tiến trình loại trừ sốt rét toàn cầu do đó cần tìm các yếu tố di truyền của ký sinh trùng sốt rét liên quan đến kháng artemisinin và xác định các markers phân tử để giám sát sự lan rộng kháng artermisinin. Ngay sau khi ra đời, các phác đồ phối hợp thuốc ACTs đã khẳng định vai trò điều trị sốt rét của nó khi nâng cao hiệu lực điều trị (cắt sốt nhanh, diệt ký sinh trùng nhanh), làm giảm tái phát sau điều trị, giảm khả năng và làm chậm sự phát triển kháng thuốc của ký sinh trùng sốt rét, giảm tác dụng phụ và có thể sử dụng rộng rãi ở nhiều đối tượng, thời gian điều trị ngắn (3 ngày) được cộng đồng chấp nhận. Hiện nay ở Việt Nam cũng như nhiều quốc gia trên thế giới sử dụng ACTs như một thuốc điềutrị sốt rét ưu tiên (first line), còn quinine được sử dụng như một thuốc tuyến hai thay thế cho ACTs (second line) trong các trường hợp thất bại điều trị bằng. Trước tình hình ký sinh trùng P.falciparum kháng thuốc artemisinine có xu hướng lan rộng ở một số quốc gia Tiểu vùng sông Mê Kông (GMS) trong đó cóa Việt Nam, từ năm 2010 WHO khuyến cáo sử dụng một số thuốc phối hợp ACTs thay cho đơn trị liệu artemisinine và dẫn chất bao gồm: artecom (DHA + P + T); artesunate + mefloquine;artemether + lumefantrine (Coartem);artesunate + chlorproguanin (Dapsone);Artesunate + Atovaquone); dihydroartemisinine + piperaquine (Artekin); artesunate + amodiaquine; artesunate + sulfadoxine/pyrimethamine (Fansidar); Artemisinine + Naphthoquine; dihydro-artemisinin + piperaquine phosphat + Primaqine phosphat + Trimethoprim (CV8).
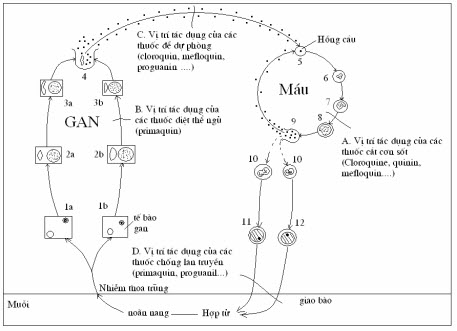
Các vị trí tác động của thuốc chống sốt rét với các thể ký sinh trùng trên các giai đoạn của chu kỳ phát triển ký sinh trùng sốt rét
Tác động sinh học của thuốc với ký sinh trùng sốt rét
Tác động thuốc trên các thể phát triển của ký sinh trùng
Để có một loại thuốc chống sốt mới đạt hiệu quả mong muốn, các nhà nghiên cứu quan tâm vị trí tác động của thuốc với ký sinh trùng sốt rét (KSTSR) trên các giai đoạn chu kỳ như diệt thể vô tính trong hồng cầu (blood schizontocides) cắt cơn sốt rét bao gồm thể tư dưỡng (Trophozoite) và phân liệt (Schizontes); diệt thể tế bào (tissue schizontocides) trong gan có tác dụng điều trị căn nguyên thể tiền hồng cầu hay ký sinh trùng ở mô đầu tiên (Primary form) của tất cả các loại KSTSR (P.falciparum, P.vivax và P.ovale, P.malariae, P.knowlesi); điều trị tiệt căn diệt ký sinh trùng ở mô thứ phát hay thể ngủ (Hypnozoites) của P.vivax và P.ovale; diệt thể giao bào (Gametocytocides) hay ức chế sự phát triển của thoa trùng (Sporotocides). Tuy nhiên, cho đến nay chưa có loại thuốc chống sốt rét nào cùng lúc tác động trên tất cả các thể phát triển của ký sinh trùng nên ưu tiên nghiên cứu tập trung vào diệt ký sinh trùng thể vô tính cắt cơn sốt, đồng thời với hạn chế sự phát triển giao bào (Gametocytes) chống lây lan. Cùng với đó, vẫn tiếp tục duy trì hiệu lực Primaquine diệt thể ẩn/thể ngủ (P.vivax, P.ovale) chống tái phát xa và diệt giao bào (P.falciparum) chống lây lan đồng thời với tìm kiếm các thuốc mới tác động với ký sinh trùng sốt rét ở các giai đoạn này, kể cả các thuốc ức chế phát triển giao bào trong cơ thể muỗi.
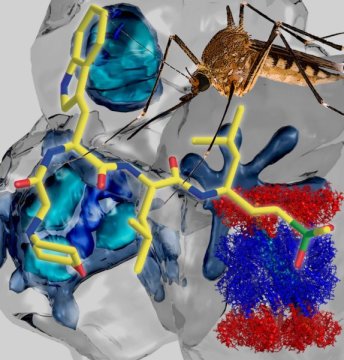
Cấu trúc proteasome của ký sinh trùng sốt rét
Ức chế proteasome của ký sinh trùng
Trong quá trình thử nghiệm tiền lâm sàng, các nhà nghiên cứu Hoa Kỳ đã phát hiện một loại phân tử nhỏ có khả năng diệt ký sinh trùng ở chuột bằng cách ức chế proteasome-cơ quan phân hủy protein của tế bào trong ký sinh trùng trong phạm vi nhỏ hơn nhiều ở vật chủ. Các tác nhân ức chế proteasome như vậy không chỉ bổ sung cho các loại thuốc điều trị sốt rét hiện tại mà còn dẫn đến phát hiện các loại thuốc điều trị bệnh lây nhiễm khác. Trước đây, các tác nhân ức chế proteasome khác nhau được sử dụng làm thuốc chống sốt rét bằng cách ức chế proteasome có thể tiêu diệt ký sinh trùng ở tất cả các giai đoạn, giảm đi xác suất là một hoặc nhiều giai đoạn của ký sinh trùng sẽ sống sót sau quá trình điều trị. Gần đây, các tác nhân ức chế proteasome có tác dụng khống chế những dòng ký sinh trùng kháng arteminisin nhưng các tác nhân ức chế đã được phát triển đều tác động đến proteasome của ký sinh trùng và con người ở mức độ như nhau trở thành độc tố với con người. Trong nghiên cứu mới, các nhà nghiên cứu đã sàng lọc các chuỗi peptit lưu trữ để xác định những chuỗi nào có lợi cho sự phân hủy proteasome của ký sinh trùng nhưng không phân hủy proteasome của con người và sử dụng những thông tin này để thiết kế tác nhân ức chế chọn lọc; sau đó họ sử dụng thiết bị quang phổ điện tử siêu lạnh để thu được hình ảnh về cấu trúc proteasome của ký sinh trùng khi liên kết với tác nhân ức chế đã được thiết kế. Tại vị trí liên kết với tác nhân ức chế, cấu trúc proteasome ở ký sinh trùng đã đưa ra những gợi ý về việc tối ưu hóa tiếp cấu trúc của tác nhân ức chế. Tác nhân ức chế chọn lọc có hiệu quả nhất với ký sinh trùng đã phát hiện là một loại phân tử tương tự peptit gọi là WLL-vs có khả năng tiêu diệt các loại ký sinh trùng sốt rét nhạy hoặc kháng với arteminisin. Một liều WLL-vs duy nhất có thể giảm đáng kể hàm lượng ký sinh trùng ở chuột mà không gây ra tác động độc hại rõ rệt nào nên rất có triển vọng ứng dụng thực tế vì các nghiên cứu trước đây đã cho thấy các tác nhân ức chế proteasome có tiềm năng tiêu diệt ký sinh trùng sốt rét ở tất cả các giai đoạn trong chu trình sống của chúng, hiện nay không có loại thuốc chống sốt rét nào có thể tiêu diệt ký sinh trùng ở tất cả các giai đoạn chu kỳ kể cả các loại thuốc có tác dụng đối với nhiều giai đoạn cũng không có tác dụng tương tự đối với các giai đoạn khác do đó tác nhân ức chế proteasome chọn lọc như WLL-vs có thể được kết hợp với arteminisin để làm giảm lan truyền kháng thuốc sốt rét.
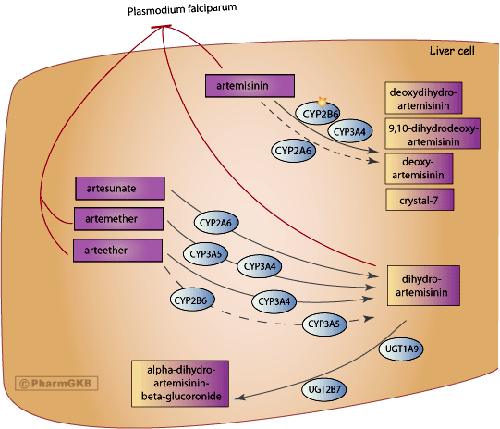
Các thuốc sốt rét mớiphải hiệu quả cao: diệt ký sinh trùng nhanh, cắt sốt nhanh, ít tác dụng phụ, giá rẻ,
được cộng đồng chấp nhận và trải qua các giai đoạn thử nghiệm lâm sàng nghiêm ngặt của WHO
Mặc dù nhu cầu thuốc chống sốt rét mới là cấp thiết nhưng để có được một sản phẩm thuốc mới hiệu quả cao: diệt ký sinh trùng nhanh, cắt cơn sốt nhanh, ít tác dụng phụ, giá cả phải chăng và được cộng đồng chấp nhận phải trải qua các giai đoạn thử nghiệm lâm sàng nghiêm ngặt của WHO theo mô tả sau đây.
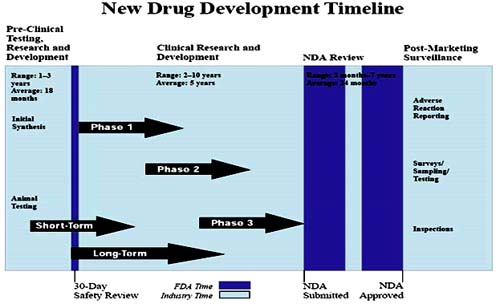
Các giai đoạn thử nghiệm lâm sàng thuốc mới
Thử nghiệm lâm sàng thuốc mới
Thử nghiệm tiền lâm sàng(Pre-clinical studies)
Các giai đoạn thử nghiệm lâm sàng(phases of clinical trials)trên người chỉ được tiến hành sau một giai đoạn tiền lâm sàng liên quan đến nghiên cứu phòng thí nghiệm (in vitro) và thử nghiệm trên động vật để đảm bảo các loại thuốc thử nghiệm được cho là an toàn và hiệu quả theo "nguyên tắc đạo đức của Hiệp hội yhọcthế giới”. Tuy nhiên, không có động vật giống như con người kể cả biến đổi gen để thực hiện thử nghiệm trên người nên các loại thuốc mới sau đó cũng phải được thử nghiệm trên người. Để bảo vệ sức khỏe của động vật nghiên cứu trong giai đoạn này, các nhà nghiên cứu được hướng dẫn 3 nguyên tắc còn gọi là 3R (Reduce-Refine-Repale) bao gồm giảm số lượng các loài động vật được sử dụng đến mức tối thiểu; hoàn thiện cách mà các thí nghiệm được thực hiện để các hiệu ứng trên động vật được giảm thiểu và phúc lợi động vật được cải thiện; thay thế động vật thí nghiệm với thay thế kỹ thuật bất cứ nơi nào có thể. Ngoài ra, hầu hết các quốc gia sẽ có cơ quan pháp quy chính thức kiểm soát nghiên cứu động vật.
Giai đoạn tiền lâm sàng thử nghiệm tính an toàn trên súc vật thực nghiệm
Sau khi thử nghiệm tiền lâm sàng được chấp nhận, các thử nghiệm lâm sàng trên người của thuốc sốt rét mới được chia thành 3 giai đoạn chính, mỗi giai đoạn có những mục tiêu cụ thể và số lượng người tham gia tăng lên khi xem xét tiến bộ từ giai đoạn tiếp theo bao gồm giai đoạn 1 xác định an toàn (determine safety); giai đoạn 2 xác định tác động của thuốc (determine whether the drug works); giai đoạn 3 xác định tính hiệu quả của thuốc (determine how effective the drug is compared to currently available, effective drugs).
Thử nghiệm phase II xác định tính dung nạp và độ an toàn của thuốc trên người bình thường
Thử nghiệm giai đoạn I(Phase I trials)
Thử nghiệm giai đoạn 1 thường là bước đầu tiên trong việc thử nghiệm một loại thuốc mới sau giai đoạn tiền lâm sàng và thí nghiệm thành công trên động vật thực nghiệm, thường có quy mô khá nhỏ và liên quan đến các đối tượng khỏe mạnh (người tình nguyện) hoặc nhóm nhỏ bệnh nhân có chung một đặc tính cụ thể nhằm đánh giá sự an toàn của thuốc thử nghiệm (assess the safety of experimental drugs); đánh giá bất kỳ tác dụng phụ có thể xảy ra (evaluate any possible side effects); xác định mức liều lượng an toàn (determine a safe dose range); xem cách cơ thể phản ứng với thuốc như hấp thụ, phân phối, loại bỏ ra khỏi cơ thể và những tác động của nó trên cơ thể (see how the body reacts to the drug how it is absorbed, distributed and eliminated from the body, and the effects that it has on the body).Liều lượng khác nhau cho người tình nguyện như tăng liều được coi là phương tiện xác định liều lượng thích hợp nhất nhưng chỉ được sử dụngliều nhỏ so với liều độc cho động vật ở nghiên cứu tiền lâm sàng.Quá trình xác định liều tối ưu (optimal dose) trong giai đoạn I bao gồm mức độ khá rủi ro cao vì là lần đầu thử nghiệm điều trị hoặc thuốc đã được dùng cho con người. Hơn nữa, phản ứng của người khỏe mạnh của các loại thuốc có thể khác với những người trong nhóm đối tượng bệnh nhân nên các loại thuốc được coi là có tiềm năng độc tính cao thường được thử nghiệm trên người từ các nhóm đối tượng bệnh nhân do vậy các thử nghiệm trong giai đoạn này thường được tiến hành trên cơ sở nội trú ít nhất là 2 tháng (63 ngày). Trong các nghiên cứu liều tăng dần đơn (single ascending dose_SAD), một nhóm nhỏ các đối tượng được sử dụng một lượng nhỏ các thuốc thử nghiệm, sau đó quan sát để biết kết quả liều gây tác dụng phụ; nếu nhóm này không xác định có tác dụng phụ, một nhóm thứ hai của các đối tượng được cho một liều hơi cao hơn của cùng một loại thuốc và cũng tiếp tục theo dõi tác dụng phụ như trên. Quá trình này được lặp đi lặp lại đến khi đạt được liều mong muốn mà tác dụng phụ không đáng kể gọi là liều dung nạp tối đa (maximum tolerated dose_MTD). Nhiều nghiên cứu liều tăng dần (multiple ascending dose_MAD) được thiết kế để thử nghiệm dược động học (pharmacokinetics) và dược lực học (pharmacodynamics) của nhiều liều thuốc thử nghiệm, một nhóm các đối tượng nhận được nhiều liều của thuốc bắt đầu từ liều thấp nhất và làm việc lên đến một mức đã định trước. Vào các thời điểm dùng thuốc khác nhau nhất là mỗi khi tăng liều, các mẫu máu và chất dịch cơ thể khác được phân tích để xác định thuốc được dung nạp vào và thải trừ như thế nào. Nghiên cứu tác động thực phẩm (food effect studies) để biết được ảnh hưởng của lượng thức ăn với hấp thu của thuốc vào cơ thể với 2 nhóm đối tượng cùng sử dụng một liều lượng thuốc thử nghiệm cho một nhóm nhịn ăn và nhóm khác sau bữa ăn.

Giai đoạn II thử nghiệm trên bệnh nhân tiêu chuẩn để xác định tính hiệu quả và liều lượng
Thử nghiệm giai đoạn II(Phase II trials)
Sau Phase I chứng minh sự an toàn ban đầu của thuốc trên một vài nhóm nhỏ người tình nguyện, giai đoạn II thử nghiệm lâm sàng được bắt đầu nhằm xác định tính hiệu quả điều trị của thuốc ở những bệnh nhân đạt tiêu chuẩn thử nghiệm hay còn gọi là thử nghiệm thăm dò điều trị (therapeutic exploratory trials)nhưng quy mô lớn hơn so với thử nghiệm lâm sàng giai đoạn I.Thử nghiệm giai đoạn II có thể được chia thành 2 giai đoạn IIA và IIB, đôi khi kết hợp cả hai.Giai đoạn IIA nhằm đánh giá các yêu cầu dùng thuốc nghĩa là bao nhiêu thuốc bệnh nhân phải nhận và đến đâu được coi là an toàn, theo đócác đánh giá an toàn trong phase I có thể được lặp đi lặp lại trên một nhóm đối tượng lớn hơnnhằm tìm hiểu thêm về tính an toàn, tác dụng phụ và cách quản lý thuốc;giai đoạn IIB tập trung vào xác định tính hiệu quả của thuốc và liều điều trị phù hợp cho bệnh nhân tiêu chuẩn. Thử nghiệm giai đoạn II có thể được thử nghiệm lâm sàng ngẫu nhiên (randomized clinical trials) liên quan đến nhóm dùng thuốc thử nghiệm (experimental drug) và nhóm sử dụng giả dược (placebo), ngoài ra tính an toàn và hiệu quả của thuốc được theo dõi chặt chẽ ở nhóm bệnh nhân được lựa chọn, nếu các thuốc thử nghiệm ở giai đoạn này được xác định hiệu quả theo yêu cầu thử nghiệm thì chuyên sang giai đoạn III.

Thử nghiệm giai đoạn III có thể mở rộng đối tượng thực địa gắn với tiếp thị thuốc mới
Thử nghiệm giai đoạn III (Phase III trials)
Phase III là giai đoạn thử nghiệm cuối cùng trước khi tiếp cận lâm sàng cho một loại thuốc mới, sẽ có bằng chứng thuyết phục về sự an toàn và hiệu của thuốc trong điều trị những đối tượng mở rộng trên một quy mô lớn hơn nhiều so với 2 giai đoạn trước ở nhiều quốc gia nhằm chứng minh điều trị hoặc thuốc được an toàn và hiệu quả sử dụng ở những bệnh nhân trong nhóm mục tiêu nghĩa là đối tượng dự kiến (demonstrate that the treatment or drug is safe and effective for use in patients in the target group i.e. in people for whom it is intended); theo dõi tác dụng phụ (monitor side effects); kiểm tra liều lượng khác nhau hoặc cách quản lý thuốc khác nhau (test different doses or different ways of administering the drug);xác định thuốc có thể được sử dụng ở các giai đoạn khác nhau của bệnh (determine whether the drug could be used at different stages of the disease); cung cấp đầy đủ thông tin cơ sở tiếp thị sản phẩm (provide sufficient information as a basis for marketing approval).
Hạn chế tự điều trị (stand-by treatment) bằng các thuốc ACTs để ngăn ngừa kháng thuốc
Lời kết
Lộ trình loại trừ sốt rét toàn cầu đến năm 2030 chỉ còn chưa đầy 15 năm nữa nhưng ký sinh trùng sốt rét kháng thuốc artemisinine và trị liệu phối hợp ACTs chính là rào cản tiếp cận mục tiêu tham vọng này, nhất là khi thuốc phối hợp ACTs có thể chỉ định rộng rãi cho cả điều trị bệnh nhân sốt rét, tự điều trị (stand-by treatment) và điều trị mở rộng nên nguy cơ kháng cao với loại thuốc phối này càng trở nên nhanh chóng. Trong khi chưa có bất kể một loại thuốc chống sốt rét mới nào có thể thay thế được ACTs, trước mắt để đối phó sốt rét kháng thuốc cần thực hiện đúng hướng dẫn của Bộ Y tế (MOH) ban hành năm 2016 và kiểm soát chặt chẽ tình hình kháng thuốc khuyến cáo của WHO, đặc biệt là hạn chế tự điều trị bằng các thuốc ACTs để ngăn chặn sự phát triển kháng thuốc.