Trên 50 năm qua, tính khẩn cấp của kháng thuốc sốt rét đối với các thuốc sốt rét được dùng phổ biến đã làm lu mờ đáng kể các nỗ lực phòng chống sốt rét với chi phí lớn liên quan sức khoẻ và đời sống con người. Kháng thuốc đồng nghĩa với thu gọn tuổi thọ của các thuốc sốt rét sẵn có và có ảnh hưởng có ý nghĩa các chương trình phòng chống sốt rét.
Tuy nhiên, ngày nay chúng ta đang ở thời kỳ mà Tổ chức Y tế thế giới (WHO) và các tổ chức quốc tế khác một lần nữa có cơ hộitiến đến loại trừ bệnh sốt rét. Nỗ lực này một phần đạt được bằng cách ghi nhận một loại thuốc kháng sốt rét có hiệu lực đó là artemisinins. Thuốc artemisinin và dẫn chất của artemisinins không chỉ làm sạch ký sinh trùng thể vô tính nhanh (giảm đi dung khối ký sinh trùng nhanh) khiến cho việc gây ra triệu chứng do nhiễm trùng giai đoan hồng cầu của ký sinh trùng giảm đi đáng kể, mà còn làm giảm số lượng ký sinh trùng thể hữu tính (các giao bào) chịu trách nhiệm cho sự lan truyền bệnh. Phối hợp với thuốc thứ hai, có thời gian bán hủy và hoạt động kéo dài hơn sẽ làm cho các thuốc phối hợp ACTs được mong đợi, nên sẽ ít cơ hội hơn trong việc phát hiện kháng thuốc.
Nhóm tác giả Jessica T.Lin, Jonathan J. Juliano, Chansuda Wongsrichanalai đang công tác tại khoa truyền nhiễm, đại học North Carolina, Chapel Hill, NC (Mỹ), Trung tâm bệnh truyền nhiễm của đại học North Carolina, 130Mason Farm Rd, Chapel Hill, NC 27514 (Mỹ) và đại học Mahidol, Thái Lan đồng tiến hành nghiên cứu cho biết vì P. falciparum kháng thuốc tiếp tục gia tăng và lan rộng trên thế giới, liệu pháp kết hợp dựa trên các dẫn chất artemisinin (ACT) đã trở thành “trung tâm” trong cuộc chiến chống sốt rét trên toàn cầu hơn một thập kỷ qua. Bài tổng hợp này bàn luận làm thế nào cải tiến giám sát kháng thuốc sốt rét và sử dụng tối ưu việc phân bổ sửu dụng thuốc ACTs sẵn có hiện nay trong các chương trình quốc gia phòng chống sốt rét, có thểtác động tối đa của liệu pháp hiệu quả cao này ngay cả khi kháng với artemisinin - đang là vấn đề khẩn cấp ở các quốc gia khu vực Đông Nam Á.
Hiểu được bản chất phức hợp của việc dùng ACTs là khó khăn, đặc biệt đối mặt với sự kháng thuốc với các thuốc kết hợp. Sự hình thành và phát triển nhiều loại ACTs và liệu pháp không ACTs (non-ACTs) hiện nay đang sử dụng trên thế giới. Bài báo này chủ yếu ôn lại những thuận lợi gần đây trong việc giám sát kháng thuốc.
Sau đó bàn luận ACTs phổ biến và liệu trình không ACTs được dùng để điều trị sốt rét kháng thuốc. Cuối cùng, bài báo điểm lại các tình huống kháng artemisinins khẩn cấp ở vùng biên giới Thái Lan - Campuchia và đến một số thuốc mới có thể đang được cung cấp.
Các thuận lợi trong giám sát kháng thuốc
Mục tiêu của giám sát kháng thuốc sốt rét là phát hiện các ca điều trị thất bại bởi ký sinh trùng kháng thuốc trước khi chúng trở nên lan rộng ra trong cộng đồng và đưa đến gia tăng tỷ lệ mắc và tử vong. Điều này là không đơn giản bởi vì ký sinh trùng sốt rét hiện nay ở các quốc gia lưu hành cũng có thể là kết quả từ một vật chủ của những yếu tố khác bao gồm điều trị không đúng, chất lượng thuốc nghèo nàn, thuốc kém chất lượng, nhiễm mới (đặc biệt ở các vùng có sự lan truyền cao) và ngay cả các mức miễn dịch khác nhau đối với sốt rét. Về mặt kinh điển, các phương pháp đo lường hiệu lực thuốc sử dụng một sự kết hợp kết quả lâm sàng từ những thử nghiệm điều trị, thử nghiệm độ nhạy của thuốc trong phòng thí nghiệm và mẫu máu phân tích dược động học. Những phương pháp tiến bộ này qua thời gian và những hướng dẫn cho việc xác định hiệu lực của liệu pháp trong ống nghiệm bây giờ đang được chuẩn hoá theo quy trình của WHO. Mặc dầu không hoàn hảo nhưng đã cung cấp một triển vọng hữu ích về ký sinh trùng, thuốc và yếu tố vật chủ mà có thể đóng góp tới thất bại điều trị. Trong thời kỳ của ACT, có nhiều khó khăn hơn để giám sát hiệu lực thuốc bởi vì nó là khó khăn để giải mã trong đó phần của phác đồ thất bại là vấn đề.
Sử dụng các chỉ điểm phân tử về nghiên cứu kháng thuốc trong những năm gần đây đã bổ sung thêm các vật liệu khác đến những nỗ lực giám sát và cái nhìn tổng quan về sự lan rộng kháng thuốc trên phạm vi toàn cầu. Vật liệu kháng thuốc đã xác định sự kháng của P. falciparum tới choloroquin (CQ), Sulfadoxine - pyrimethamine (chúng kết hợp lại tạo thành Fansidar; Roche, Basel, Switzerland), Atovaquone - proguanil (Malarone; GlaxoSmithKline, Research Triangle Park, NC) và kháng hoặc giảm nhạy tới một mức độ giới hạn cho các thuốc kháng sốt rét khác. Đối với thuốc CQ và thuốc SP, chúng bao gồm nhiều hình dạng nucleotide đơn (SNPs) trong các gen mã hoá một protein vận chuyển màng không bào và các enzyme liên quan đến sự tổng hợp folate mang tính riêng lẽ.
Các ký sinh trùng đã phát triển kháng đến cả 2 loại CQ và SP và sau đó phát phát triển kháng thuốc đến một thuốc ở thực địa thứ 3 đựoc gọi là “đa kháng". Các bệnh nhân có số bản sao liên quan đến chỉ điểm Pfmdrl gia tăng (P. falciparum đa kháng gen 1) mã hoá Pfgh1, một bơm vận chuyển có chủ ý, được tìm thấy giảm đáp ứng với mefloquine, quinine, Lumefantrine và các thuốc ACTs kết hợp chứa các thuốc này.
Gần đây hơn, genPfmrp(loại protein liên quan đến kháng thuốc) có liên quan với sự tuôn ra của thuốc trong các ký sinh trùng được nuôi cấy và SNPs trong gen Pfmrp được quan sát ở các bệnh nhân tái nhiễm sau khi điều trị bới ACTs loại artemether - lumefantrine. Cuối cùng, sự đề kháng tới hợp chất Atovaquone của Atovaquone-proguanil cùng địa điểm mà xác định sự đề kháng Atovaquone của Pneumocystis carinii.
Mặc dầu sử dụng vật liệu phân tử cho giám sát có thể nguồn vốn lớn và thường là không dự báo của kháng thuốc lâm sàng ở các bệnh nhân riêng lẻ, tiềm năng để phát hiện khuynh hưóng kháng thuốc khẩn cấp trước khi thất bại lâm sàng rõ ràng làm cho chúng trở thành các vật liệu hữu ích cho những người làm chính sách chuẩn bị cho sư thay đổi chính sách thuốc từng quốc gia theo từng giai đoạn. Sử dụng các vật liệu phân tử cũng giúp làm sáng tỏ nguồn gôc phân bố địa lý và sự lan rộng kháng thuốc về mặt lịch sử. Phân tích của các gen đột biên ở Pfcrt, Dhfr và Dhps và các ảnh chụp vệ tinh nhỏ bên cạnh chứng tỏ rằng các chủng kháng thuốc phát triển trong một vài ổ rồi sau đó lan đến các vùng lưu hành khác. Những phân tích này hỗ trợ lý thuyết trong thời gian dài rằng ký sinh trùng kháng CQ đầu tiên xuất hiện dọc theo biên giới Thái Lan - Campuchia vào những năm 1950 và lan rộng ra cả Đông Nam Á, sau đó di chuyển đến Đông Phi vào những năm 1970 và lan rộng ra cả châu Phi vào những năm 1990. Tương tự như thế, người ta chứng minh rằng kháng pyrimethamine đầu tiên gần biên giới Thái Lan - Campuchia trong những năm 1960 tiến triển đến loại bộ ba đột biến ("triple mutant") kháng cao, rồi lan rộng ra các vùng khác ở châu Á tới châu Phi. Nguồn gốc của chủng ký sinh trùng sốt rét kháng thuốc này ở trong vùng lan truyền thấp vẫn còn là một nghịch lý muốn tìm hiểu trong sốt rét học.
Khả năng mang tính hiệu quả của ACTs và sự thúc đẩy loại trừ sốt rét và WHO đến bây giờ khuyến cáo các quốc gia chính sách điều trị kháng sốt rét của họ đến một phác đồ ưu tiên một (“first line) mới khi thất bại điều trị vượt quá 10% và cho rằng một thuốc mới đang được chấp nhận như là chính sách phải có tỷ lệ thất bại dưới hoặc bằng 5%. Những nỗ lực để thu thập và trình bày dữ liệu hiệu quả của thuốc trong một mô hình thống nhất mà nó cho phép so sánh theo một cách thống nhất của mạng lưới kháng thuốc sốt rét toàn cầu (WWARN). Vai trò quyết định đối với một hệ thống giám sát toàn thế giới của sốt rét kháng thuốc không bị thách thức ở giai đoạn gia tăng này mang tính toàn cầu.
Mô hình kháng các loại thuốc sốt rét trên thế giới
Về mặt lịch sử, khu vực Đông Nam Á là trung tâm “nổi trội so với các vùng khác” của sốt rét kháng thuốc. Tuy nhiên, một vài nơi khác trên thế giới hiện nay chưa chịu ảnh hưởng của sốt rét kháng thuốc. Trung Mỹ, phía bắc kênh đào Panama và vùng Caribe vẫn còn là nơi nhạy với CQ phổ biến. Ở khu vực Nam Mỹ, kháng thuốc CQ đã lan rộng rất nhiều năm, trong đó một phần của vùng Amazon có kháng SP ở mức độ cao và kháng mefloquine đã được mô tả, mặc dầu mức độ kháng không bằng Đông Nam Á.
Ở khu vực Đông và Nam Phi, ký sinh trùng sốt rét kháng SP ở mức độ cao. So sánh cho thấy các vùng khác của khu vực Tây Phi vẫn còn kháng SP ở mức độ tương đối thấp. Ở châu Phi, thuốc amodiaquine (AQ) nói chung hiệu quả hơn thuốc CQ, nhưng có một sự kháng chéo với CQ và hiệu quả của AQ đang giảm. Khu vực Nam Á và Trung Đông cũng có kháng SP nhưng nói chung nhạy với mefloquine.
Vào cuối những năm 1990 và đầu những năm 2000, sự biến mất tính hiệu quả của thuốc kháng sốt rét dẫn đến các thử nghiệm liệu pháp kết hợp như CQ + SP, AQ + SP và chlorproguanil + dapsone ra đời. Tuy nhiên, thành công của việc kết hợp hai loại thuốc thất bại dự báo là không cao và một loại thuốc khángsốt rétmới có hiệu lực là cần thiết.
Lý do để triển khai sử dụng liệu pháp ACTs và các liệu trình phổ biến đang dùng
Các đặc tính kháng sốt rét của artemisinin và dẫn chất – artemether, artesunate (AS), và dihydroartemisinin (DHA) đã được phát hiện bới Trung Quốc vào những năm 1970. Tuy nhiên mãi cho đến những năm 1990 các thuốc này được chấp nhận ở các phần còn lại của thế giới. Rồi thì artemisinin đơn thuần được áp dụng rộng rãi ở Châu Á. Cộng đồng sốt rét ý thức rằng để bảo quản loại thuôc sốt rét hiệu quả này, một sự thúc đẩy liệu pháp kết hợp trên thế giới là cần thiết. Vào năm 2001, Tổ chức Y tế thế giới khuyến cáo sử dụng ACTs ở các quốc gia nơi mà P. falciparum đã phát triển sự đề kháng tới các thuốc sốt rét theo quy ước, với lý do tỷ lệ khỏi bệnh cao và làm giảm sự lan rộng kháng thuốc. Số lượng các quốc gia chấp nhận liệu pháp ACTs như là liệu pháp đầu tiên theo khuyến cáo của WHO vào năm 2006 trong điều trị sốt rét do P. falciparum đã gia tăng nhanh chóng đến 88 quốc gia và vùng lãnh thổ vào năm 2009 bao gồm phần lớn các quốc gia ở Châu phi.
Cùng với liệu pháp kết hợp phòng chống bệnh lao và HIV, ý tưởng đằng sau liệu pháp ACTs là đạt được một rào cản gia tăng sự đề kháng bằng cách dùng các thuốc có cơ chế hoạt động khác nhau phối hợp nhau, nên buộc ký sinh trùng phát triển các biên đổi đồng thời nhân lên để trở nên đề kháng là khó. Bởi vì các artemisinins làm giảm dung khối ký sinh trùng một cách đặc hiệu nhanh chóng tới 108 lần chỉ trong 3 ngày, nhưng loại thải KSTSR trong máu chỉ 1 đến 3 giờ, vì vậy nói chung chúng thất bại khi có một thuốc kết hợp có thời gian bán huỷ dài hơn và có thể tiêu diệt các ký sinh trùng còn lại. Điều này cho phép các liệu trình ngắn hơn, 3 ngày để thúc nhanh sự gắn kết. Mặt khác, ở các nơi có sự lan truyền cao, cái đuôi của thuốc có tác dụng kéo dài có thể thúc đẩy sự nảy sinh ký sinh trùng sốt rét kháng thuốc phơi nhiễm do mức thuốc không đạt chuẩn. Như thế vì nhiều lý do, điều thiết yếu là các thuốc kết hợp vẫn còn hiệu lực, đạt hơn 80% điều trị khỏi là lý tưởng. Sự không hiệu quả kết hợp một dẫn chất artemisinins với một thuốc được biết đã bị kháng chứng tỏ bởi sự thất bại đột ngột của artesunate - CQ. Hiện nay, WHO khuyến cáo sử dụng sự kết hợp 5 loại ACTs phổ biến với thuốc thứ 5 nói chung cũng được chấp nhận là an toàn và hiệu quả. Gần đây tạp chí Cochrane điểm lại rằng qua 50 nghiên cứu liên quan về thuốc ACTs liền kề, tất cả có 5 thuốc phối hợp ACTs đã được nêu trên đạt tỷ lệ thất bại thấp dưới 10% ở hầu hết các điểm nghiên cứu liên tục không có ngoại lệ.
Phối hợp Artesunate- Mefloquine.
Artesunate - mefloquine (ASMQ), là một thuốc ACTs được dùng rộng rãi đầu tiên, được triển khai ở các vùng biên giới của Thái Lan vào năm 1994 trong một nỗ lực kiềm soát sốt rét có mức kháng mefloquine rất cao. Phác đồ này nói chung vẫn còn hiệu quả ở các vùng lưu hành sốt rét của Thái Lan. Đáng kể là tỷ lệ mắc sốt rét ở một điểm vùng Tây bắc của Thái Lan giảm 50% chỉ trong vòng 2 năm sau khi áp dụng liệu pháp phối hợp ASMQ và tiếp tục giảm sau đó. Sự giảm tỷ lệ mắc sốt rét trên cơ sở hiệu quả của điều trị thành cồng và được tin là do giảm người mang giao bào sau khi điều trị, làm cho bệnh nhân ít nhiễm bởi muỗi.
Hiện nay, phác đồ thuốc ASMQ được sử dụng ở Campuchia, Thái Lan và Myanmar và một số quốc gia khác ở Nam Mỹ. Tính an toàn ở trẻ em và phụ nữ có thai của phác đồ ASMQ được giám sát cẩn trọng. Tuy nhiên thời gian bán huỷ kéo dài của mefloquine xấp xỉ 2 đến 3 tuần, làm cho thuốc không thích hợp ở các nơi lưu hành nặng như ở châuPhi, nơi màthuốc không đủ liệu trình cho tới 3 đến 5 tuần sau khi điều trị đối mặt với tỷ lệ tái phát sớm cao có thể nhanh chóng dẫn đến kháng thuốc. !important; |
Phối hợp Artemether-Lumefantrine
ACTs đầu tiên có cùng công thức là artemether-lumefantrine (AL) (Coartem !important; Novartis AG, Basel, Switzerland), trở nên phổ biến vào năm 2004. Lumefantrine có liên quan tới mefloquine nhưng thời gian bán huỷ ngắn hơn (4-5 ngày) và điều quan trọng là không bao giờ là thuốc đơn trị liệu. Để chống lại P. falciparum kháng thuốc, liều trình sáu liều của Coartem AL đã chứng tỏ hiệu quả và dung nạp tốt hơn artesunate-mefloquine. Các ngoại lệ quan trọng đối với hiệu quả của AL rộng rãi là ở Tây – Cambodia và ở Uganda, nơi có tỷ lệ thất bại khảng 15% đã được báo cáo. Ở Kenya, tái nhiễm sau điều trị thưòng xuyên có mối liên quan với các gen của ký sinh trùng kháng lumefantrine.
AL đã trở thành loại thuốc ACTs phổ biến nhất ở châu Phi, với hơn 30 quốc gia chấp nhận nó như là thuốc sử dụng tuyến đầu hay ưu tiên một vào năm 2009. Nó cũng là thuốc ACTs duy nhất được cấp phép ở Mỹ. Vẫn còn những cản trở để đạt được kết quả tối ưu bao gồm vấn đề dùng thuốc nhiều hơn hai lần hàng ngày trên 3 ngày và nhu cầu bữa ăn có chất béo để hấp thụ tối ưu thuốc, trái lại hầu hết bệnh nhân cấp tính có thu nhận bằng đường miệng kém. Vẫn còn liệu trình không giám sát ở Uganda và Malawi có tỷ lệ khỏi cao tới 98%. Có bằng chứng gia tăng rằng AL là an toàn cho phụ nữ mang thai ở thai kỳ thứ 2 và thứ 3, mặc dầu liệu trình dài hơn có thể cần thiết bởi vì nồng độ thuốc trong huyết tương thấp hơn của artemether, dihdroartemisinin (DHA) và Lumefantrine. Thuốc cho trẻ em cũng đã chứng tỏ có hiệu lực cao trong một nghiên cứu liên quan đến một số quốc gia khu vực vùng sốt rét lưu hành châu Phi. !important;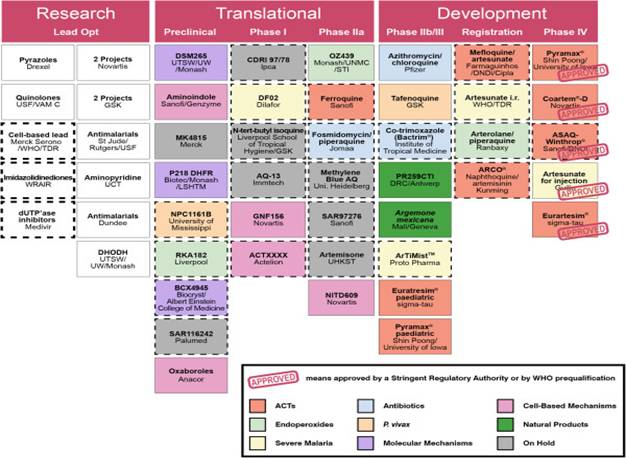 |
Phối hợp Artesunate-Amodiaquine
Amodiaquine (AQ) loại thuốc thuộc nhóm 4-aminoquinoleine giống thuốc CQ. Thuốc có tác dụng chống lại các chủng ký sinh trùng kháng thuốc CQ, mặc dầu có một số kháng chéo qua các số liệu nghiên cứu trên y văn. Như thế, trong các vùng SRLH có kháng CQ lan rộng, thì thuốc artesunate- amodiaquine (ASAQ) không được khuyến cáo. Hiệu quả của ASAQ khác nhau trong các vùng khác nhau ở châu Phi, nhưng được duy trì ở những nơi liệu trình đơn AQ 28 ngày có tỷ lệ khỏi bệnh hơn 80%. Một thuốc kết hợp đang được triển khai ở Tây Phi. Mặc dầu gây giảm bạch cầu trung tính, thoái hoá bạch cầu và viêm gan có liên quan đến liệu trình dự phòng bằng AQ trong quá khứ nhưng không được mô tả trong liệu trình điều trị ở đây.
Điều trị nói chung thuốc dung nạp tốt mặc dù các báo cáo rải rác tồn tại không dung nạp đuợc tìm thấy do các tác dụng ngoại ý hay tác dụng không mong muốn. Các tác dụng phụ này làm bệnh nhân không sử dụng AQkhi nó làm rộp da bởi artesunate. Hơn nữa, giảm bạch cầu trung tính đã được tìm thấy phổ biến ở những trẻ em nhiễm HIV hơn ở những trẻ không nhiễm HIV khi sử dụng thuốc AQ. Tuổi thọ của loại ACTs này có thể bị giới hạn bởi gia tăng sự đề kháng CQ và AQ trong thời gian qua.  !important; !important; |  |
Phối hợp Artesunate - Sulfadoxine-Pyrimethamine
Như đã bàn luận, một số mức độ kháng của SP bây giờ đang lan rộng nhưng SP riêng rẽ, nhưng thuốc lại có tính ưu việt là dung nạp tốt, liều duy nhất và có thời gian bán huỷ tương đối dài. Ở những nơi mà hiệu lực của SP vẫn còn hơn 80%, artesunate-sulfadoxine-pyrimethamine (AS-SP) đã chứng tỏ tính hiệu quả. Sự bổ sung AS cũng làm giảm đáng kể số người mang giao bào, một hiểu biết không hướng tới việc thúc đẩy liệu trình đơn SP trị liệu. Bởi vì thuốc SP và các thuốc kháng folate khác như cotrimoxazole sẽ tiếp tục sử dụng rộng rãi trong liệu trình đơn trị liệu cho việc dự phòng cách quãng trong thời kỳ mang thai và dự phòng nhiễm trùng cơ hội ở bệnh nhân nhiễm HIV, hiệu quả của kết hợp ACTs này mong đợi sẽ bị suy giảm theo đánh giá theo thời gian. Thuốc đã được chấp nhận như là liệu trình tuyến đầu hay ưu tiên một ở quốc gia Ấn Độ vào năm 2007 và được sử dụng nhiều ở Trung Đông và nhiều vùng của khu vực Nam Mỹ.
Phối hợp Dihydroartemisinine – Piperaquinec phosphate
Piperaquine cũng là loại thuốc thuộc nhóm 4 - aminoquinoine liên quan tới CQ. Thuốc đã được sử dụng kể từ năm 1978, chủ yếu ở Trung Quốc. Thời gian bán huỷ của thuốc rất dài (4-5 tuần). Phối hợp thuốc DHA-PPQ dung nạp tốt, liều duy nhất hàng ngày và đã chứng tỏ có hiệu quả tuyệt vời nhằm chống lại các chủng đa kháng ở các quốc gia Đông Nam Á với tỷ lệ khỏi bệnh từ 97% đến 100%. Gần đây, Corchane điểm lại trên 17 nghiên cứu liên quan đến phác đồ thuốc DHA-PPQ kết luận rằng ít nhất thuốc có hiệu quả như ASMQ ở các vùng sốt rét lưu hành tại châu Á và có lẽ hiệu quả hơn cả AL và ASAQ ở châu Phi. Mặc dù, thuốc đang là một trong nhiều hứa hẹn hơn của nhóm thuốc ACTs, nhưng nó chưa nằm trong danh mục khuyến cáo của WHO vào năm 2006 bởi vì thuốc vẫn chưa được cấp phép theo Thực hành sản xuất thuốc tốt (GMP) quốc tế. Thuốc kết hợp mang tính thương mại ở châu Á như là Artekin (do công ty dược phẩm Holleykin Pharmaceutical Co.,Ltd, Guangzhou, Trung Quốc cung cấp) và Duo-Cotecxin (do công ty Beijing Holley-Cotec Pharmaceuticals Co.Ltd, Beijing, Trung Quốc sản xuất và cung cấp) một thời gian và bây giờ cũng được tìm thấy sử dụng tại nhiều nơi ở khu vực châu Phi. Gần đây, mối quan tâm gia tăng rằng hợp chất DHA+PPQ được hình thành ở một liều rất thấp trong các viên nén kết hợp, có hiệu quả cao ở thực địa nghiên cứu in vivo.
Nhiều vấn đề vẫn còn cần thiết nhấn mạnh nếu liệu pháp thuốc phối hợp ACTs kết thúc hiệu lực toàn bộ và có một tuổi thọ mở rộng hơn. Mặc dầu các thuốc kết hợp bây giờ sẵn sàng cho một số ACTs chúng là không phải không có những hạn chế. Nhìn chung các ACTs có thời gian sử dụng ngắn hơn thuốc không ACTs. Kết quả là các hãng phân phối hạn chế chấp nhận các thuốc artemisin bằng đường uống dựa trên kết hợp với thời gian sử dụng không quá 2 năm.
Các nỗ lực để loại bỏ thuốc giả và thuốc kém phẩm chất và buộc cấm quảng cáo artemisinins dùng đường uống dạng đơn trị liệu. Các tài liệu trước đây chứng minh rằng 33 - 53% artesunate viên được điều tra ở các quốc gia thuộc tiểu vùng sông Mê Kông là thuốc giả, mặc dù tỷ lệ được tin là thấp hơn nhiều so với hiện nay. Cùng với tất cả các liệu pháp, hạ tầng cơ sở và các dịch vụ y tế phải được cải thiện để đảm bảo không chỉ rằng thuốc đến với những ai cần chúng nhất mà còn tránh điều trị quá mức khi không có bằng chứng về ký sinh trùng dương tính trên các ca bệnh. Không nơi nào thích hợp hơn ở châu Phi. Cuối cùng, những nghiên cứu về tính an toàn của phác đồ ở phụ nữ có thai đặc biệt trong thai kỳ đầu và bệnh nhân nhiễm HIV mắc sốt rét đồng thời là cần thiết. Tuy nhiên, nhìn chung các nhóm thuốc ACTs được khuyến cáo là dung nạp tốt và trở nên là liệu pháp điều trị sốt rét chính trên toàn thế giới. !important; |
Liệu trình điều trị không ACTs với sốt rét kháng thuốc
Mặc dù ACT được ghi nhận như là sự lựa chọn tốt nhất trong điều trị sốt rét không biến chứng, liệu trình điều trị không ACTs có thể giữ một vai trò trong một số trường hợp. Ví dụ đáng chú ý nhất là sự kết hợp của AQ và sulfadoxine-pyrimethamine (AQ-SP), mà đó là một liệu pháp kết hợp triển vọng trước khi các thuốc ACTs trở nên phổ biến hơn. Thời gian bán huỷ dài của hai thuốc kết hợp cho phép thuốc làm giảm tỷ lệ tái nhiễm tốt hơn ASAQ hay AS-SP. Kết quả từ 4 nghiên cứu liên tục ngược với AS-SP ở châu Phi chứng tỏ rằng thuốc trở nên hiệu quả hơn, mặc dầu AS-SP được dự đoán là tốt hơn trong việc làm giảm người mang giao bào. Trong khi đó, các ACTs khác là ưu việt hơn AQ-SP ở Đông Phi. Hiện WHO khuyến cáo sự kết hợp này như là một sự lựa chọn tạm thời nơi mà ACTs không sẵn có và SP và AQ hiệu lực vẫn còn nhạy cao (> !important; 80%.
Nơi nào mà thuốc ACTs hay liệu pháp kết hợp ACTs khác không sẵn có thì quinine (QNN) đơn thuần bằng đường uống thường là liệu trình ưu tiên hai (second line) được chọn lựa với điều trị sốt rét do P. falciparum không biến chứng. Trong số 41 quốc gia châu Phi chấp thuận dùng ACTs như là liệu trình tuyến đầu tiên hay ưu tiên một, thì có 29 quốc gia sử dụng QNN như là phác đồ tuyến hai của họ. Trong thực tế, điều này nghĩa là QNN đơn thuần được sử dụng rộng rãi. Trong năm 2005, có một số báo cáo rải rác cho biết thất bại của QNN từ các quốc gia Đông Nam Á, Tây Thái Bình Dương và Sudan. Tuy nhiên, điều này không phản ánh hiệu quả thực sự trên thế giới bởi vì QNN sử dụng bằng đường uống là không dung nạp tốt bởi các tác dụng phụ như gây ra ù tai, chóng mặt và nôn mửa và cũng đòi hỏi uống 3 lần trong ngày phức tạp. Như thế, liệu trình dùng 7 ngày liên tục luôn luôn là câu hỏi? Một nghiên cứu gần đây ở Uganda so sánh với AL sử dụng tuyến đầu tiên với QNN ưu tiên hai xác nhận tính nghi ngờ này bởi vì tỷ lệ thất bại do QNN là cao hơn có ý nghĩa và liên quan đến các tác dụng phụ khó có thể chấp nhận. Điều này thúc đẩy nhanh đối với thuốc ACTs được sử dụng như là liệu trình điều trị thay thế second line. Ở các quốc gia Đông Nam Á và Nam Mỹ, nơi mà liệu trình QNN đơn thuần không có hiệu quả, thì QNN và tetracycline liệu trình 7 ngày trong liệu trình tuyến hai và QNN đơn thuần cho phụ nữ mang thai.
Atovaquone- proguanil là một liệu trình kết hợp dùng 3 ngày hợp lực mà có hiệu quả đáng tin cậy chống lại ký sinh trùng đa kháng thuốc của P. falciparum. Thuốc dung nạp tốt và có hiệu lực cao khi kết hợp liều dùng cố định. Tuy nhiên, giá thành cao của nó khó có thể sử dụng trên diện rộng ở các quốc gia có nguồn lực không dồi dào. Hơn nữa, có một sự quan tâm rằng sự kháng thông qua sự nhân lên trong hệ thống Cytochrome b cũng nảy sinh nhanh chóng dưới áp lực thuốc. Tuy nhiên, ghi nhận tính hiệu quả nó đựợc chọn cho chính sách kháng artemisinine và các nỗ lực loại trừ chủng P. falciparum ở vùng biên giới Đông Nam của Thái Lan và Campuchia.
Tính khẩn cấp do kháng thuốc artemisinins
Hoạt hoá nhanh chóng của artemisinins và sự loại thải nhanh chóng từ huyết tương dựa trên lý thuyết dược học là các rào cản đối với sự phát triển kháng thuốc. Tuy nhiên, các báo cáo của hơn 20% thất bại của liệu trình ASMQ từ cả 2 phía quốc gia của khu vực biên giới Thái Lan - Campuchia đầu tiên xuất hiện vào đầu những năm 2000. Các báo cáo tạo ra các quan tâm lớn bởi vì không có thuốc dự phòng cho ACTs hiện nay không sẵn có, nếu quả chăng kháng thuốc ACTs luôn thì sẽ vấn đề ra sao?
Bởi vì tính ưu việt của liệu pháp artemisinins là thời gian sạch ký sinh trùng nhanh chóng, và mefloquin là một thuốc hoạt động chậm hơn với thời gian bán hủy dài hơn, nên khi có sự xuất hiện thời gian làm sạch ký sinh trùng chậm (kéo dài hơn) đối với phác đồ ASMQ được cho là phản ánh sự giảm nhạy cảm với artemisinins. Dữ liệu từ ASMQ trong nghiên cứu thực địa kéo dài hơn một thập kỷ ở vùng biên giới Thái Lan đã chứng tỏ thời gian sạch ký sinh trùng càng chậm gia tăng. Tỷ lệ ký sinh trùng của các đối tượng tham gia nghiên cứu vào ngày thứ 3 (D3) gia tăng từ 0% (năm 1997) tới 13% (năm 2007) với chỉ số của ký sinh trùng trong máu vào ngày thứ 3 (D3) gia tăng, trung bình 32% mỗi năm. Trong khi đó, ở biên giới của Campuchia, giám sát độ nhạy của thuốc thời gian dài trong phòng thí nghiệm của hơn 800 mẫu P. falciparum phân lập đã chứng tỏ sự gia tăng nồng độ ức chế IC50% của thuốc artesunate từ năm 2001 – 2007.
Để loại bỏ nơi nào thất bại của phối hợp thuốc ASMQ đại diện cho sự kháng artemisinine về mặt lâm sàng thực sự ngược lại với sự giảm hiệu lực của các thuốc kết hợp như với mefloquin, một loạt các thử nghiệm lâm sàng sử dụng liệu pháp điều trị artesunate đơn thuần được thực hiện ở phía tây Campuchia. Chiến lược dùng liệu pháp artesunate đơn thuần đường uống có hiệu quả bị dừng lại và thay thế vào đó là thuốc phối hợp như là một sự thay đổi. Ba thử nghiệm, được tiến hành từ năm 2006 đến 2009 sử dụng các liều artesunate khác nhau từ 2 mg/kg/ngày đến 6mg/kg/ngày trong 7 ngày.
Kết quả lâm sàng tổng quan đôi khi không đem lại kết quả, khác nhau từ hiệu quả 70% (14/20) ở Pailin sử dụng liều 2mg/kg tới ≥ 90% hiệu quả ở 2 thử nghiệm liên tiếp cạnh vùng Tasanh sử dụng cả 2 liều 2mg/kg và 4mg/kg. Liệu trình liều cao 6mg/kg ở Tasanh tạm dừng truớc khi hoàn thành bởi vì lý do giảm bạch cầu trung tính được quan sát nhưng không chứng tỏ tác động của liều artesunate cao hơn trên thời gian sạch ký sinh trùng hay tỷ lệ thất bại. Điều đáng chú ý những thử nghiệm này được tiến hành 3 - 5 năm sau các nghiên cứu ban đầu chứng minh sự thất bại của phối hợp ASMQ. Trong giai đoạn này, có một sự giảm tỷ lệ sốt rét do P. falciparum và một sự thay đổi trong mô hình sử dụng ACTs ở phía Tây Campuchia với sự chuyển hướng sử dụng phác đồ DHA+PPQ nhiều và phổ biến hơn, DHA+PPQ là loại thuốc trở nên phổ biến trong các dịch vụ tư nhân trong tương lai?
Phát hiện chủ yếu từ 3 thử nghiệm cho rằng các bệnh nhân ở phía Tây Campuchia có thời gian sạch ký sinh trùng chậm hơn đối với liệu trình artesunate. Ở Palin, bệnh nhân sạch ký sinh trùng trung bình là 3,5 ngày (84 giờ). Ít nhất nữa số bệnh nhân ở Tasanh phải mất ít nhất 3 ngày mới sạch ký sinh trùng.
Điều này là ngược lại thời gian sạch ký sinh trùng đựoc phát hiện ở những bệnh nhân Thái Lan (30 giờ) được cho artesunate bằng đường uống vào những năm 1990. Phát hiện này là quan trọng bởi vì thuận lợi của artemisine về nguyên lý dược động học là thúc đẩy sạch ký sinh trùng ở giai đoạn nhẫn trẻ ngăn ngừa sự nhân lên hơn nữa và sự ẩn cư của những ký sinh trùng này. Như vậy, các dữ liệu cho biết mức độ kháng đối với artemisinine trong số ký sinh trùng ở vùng này.
Tỷ lệ bệnh nhân vẫn còn ký sinh trùng vào ngày thứ 3 (D3) bây giờ đề xuất như là chỉ điểm cho thử nghiệm đánh giá kháng thuốc thực địa của P. falciparum kháng artemisinins. Tuy nhiên, phát hiện sớm sự kháng artemisinine lan rộng trở nên một cố gắng lớn bằng cách xác định một chỉ điểm phân tử của kháng. Các nỗ lực đang được thực hiện để làm sáng tỏ các gen ký sinh trùng sốt rét kháng thuốc bằng cách sử dụng các phân lập từ những thử nghiệm trên và những phân lập khác được thu thập trong giai đoạn tới thông qua sự hợp tác của WWARN. Các nghiên cứu về bộ gen mở rộng và những phân tích phân tử khác đang được áp dụng với hy vọng rằng xác định các vật liệu phân tử mới, trong khi cũng xác nhận những hiểu biết và các chỉ điểm phân tử mới nổi đóng góp vào kháng thuốc.
Các kế hoạch thanh toán bệnh sốt rét tức thì bị cản trở bởi sự kháng thuốc của CQ có nguồn gốc dọc biên giới Thái Lan - Campuchia. 50 năm sau đó, không có gì nghi ngờ tính khẩn cấp của kháng artemisinine từ những vùng tương tự đầy tiềm tàng có thể phá huỷ các thành quả và một lần nữa đe doạ các thành tựu PCSRtrong vài chục năm qua. Trong một đáp ứng tức thì, các hoạt động chiến lược kháng artemisinine đã bắt đầu ở vùng biên giới này với mục tiêu loại trừ chủng P. falciparum trong vùng. Người ta hy vọng rằng những nỗ lực như thế có thể được duy trì đủ dài để đạt mục tiêu mong đợi. Các kế hoạch thanh toán tức thì bị cản trở bởi kháng thuốc CQ có nguồn gốc và bắt đầu từ các vùng dọc biên giới Thái lan - Campuchia
Dựa vào các phối hợp thuốc ACTs: Các thuốc mới đang sẵn sàng!
Các thuốc kháng sốt rét mới từ các nhóm hoá chất đa dạng tác động vào các giai đoạn ký sinh trùng khác nhau về giai đoạn thử nghiệm đích là nhu cầu khẩn thiết cho phép áp dụng mà không cần quan tâm kháng tồn tại trước đây. Điểm lại các thuốc sốt rét mới đang phát triển đã được ra đời và ấn bản gần đây. Trong số đó, pyronaridine-artesunate (biệt dược Pyramax do công ty ShinPoong Pharm. Co. Ltd, Seoul, Hàn Quốc sản xuất) là một loại ACTs mới với liệu trình 1 viên/ ngày trong thời gian 3 ngày là thuốc đại diện có tiềm năng thuận lợi so với ACTs khác về các tác dụng không mong muốn. Pyronaridine là một thuốc tổng hợp liên quan đến CQ, nó không có biểu hiện kháng chéo nhiều như với CQ, QNN hay mefloquine. Giai đoạn 3 về thử nghiệm lâm sàng của pyronaridine-artesunate ở châu Phi và các quốc gia Đông Nam Á đã hoàn thành và sự chấp nhận thuốc sẽ được đệ trình đến các hãng thuốc của châu Âu vào đầu năm 2010.
Artemisone (Artemifone) là một dẫn chất artemisinin bán tổng hợp. Cấu trúc hoá học khác biệt của chúng so với artemisinins có thể làm cho nó có hiệu lực hơn với ký sinh trùng ở vùng biên giới Thái Lan - Campuchia. Các kế hoạch thực hiện giai đoạn thử nghiệm 2b về hiệu lực làm sạch ký sinh trùng sẽ được đánh giá.
Cuối cùng, Rbx 11160 (hay OZ277)là một ozon tổng hợp, chỉ đạt 60% tới 70% hiệu quả lâm sàng khi dùng đơn trị liệu nhưng đạt hiệu quả đáng kể khi được kết hợp với piperaquine phosphate. Công thức kết hợp này đang hướng đến giai đoạn 3 về thử nghiệm lâm sàng. Sự khác nhau về cấu trúc của Rbx11160 từ các artemisinine bán tổng hợp cũng có thể giúp các chủng kháng artemisins đích.
Kết luận
Các tiến triển không ngừng của ký sinh trùng sốt rét kháng thuốc đã được dự báo trước. Không phải tất cả mà xảy ra chỉ một số quốc gia bây giờ chấp nhận ACTs như là chính sách thuốc sốt rét thiết yếu, sự phát triển và lan rộng kháng của P. falciparum với artemisine là một nỗi sợ bao trùm. Để ngăn chặn điều này xảy ra, một sự hiểu biết đầy đủ những vấn đề xung quanh sử dụng ACTs thích hợp kết hợp với tăng cường giám sát kháng thuốc là cần thiết. Chỉ với những nỗ lực cao độ này chúng ta có thể kéo dài tuổi thọ của ACTs và giữ được kết quả phòng chống sốt rét trong những thập kỷ gần đây đạt được.
Tài liệu tham khảo
1.Trape JF. The public health impact of chloroquine resistance in Africa. Am J Trop Med Hyg. 2001 !important; 64:127.
2.World Health Organization. Methods for Surveillance of Antimalarial Drug Efficacy. Geneva: World Health Organization !important; 2009.
3.Laufer MK. Monitoring antimalarial drug efficacy: current challenges. Curr Infect Dis Rep. 2009 !important; 11:59–65.[PubMed: 19094826]
4.Price RN, Uhlemann AC, Brockman A, et al. Mefloquine resistance in Plasmodium falciparum and increased pfmdr1 gene copy number. Lancet. 2004 !important; 364:438–447. [PubMed: 15288742]
5.Lim P, Alker AP, Khim N, et al. Pfmdr1 copy number and arteminisin derivatives combination therapy failure in falciparum malaria in Cambodia. Malar J. 2009 !important; 8:11. [PubMed: 19138391]
6.Picot S, Olliaro P, de Monbrison F, et al. A systematic review and meta-analysis of evidence for correlation between molecular markers of parasite resistance and treatment outcome in falciparum malaria. Malar J. 2009 !important; 8:89. [PubMed: 19413906]
7.Raj DK, Mu J, Jiang H, et al. Disruption of a Plasmodium falciparum multidrug resistance- associated protein (PfMRP) alters its fitness and transport of antimalarial drugs and glutathione. J Biol Chem. 2009 !important; 284:7687–7696. [PubMed: 19117944]
8.Dahlström S, Ferreira PE, Veiga MI, et al. Plasmodium falciparum multidrug resistance protein 1 and artemisinin-based combination therapy in Africa. J Infect Dis. 2009 !important; 200:1456–1464. [PubMed: 19807279]
9.Korsinczky M, Chen N, Kotecka B, et al. Mutations in Plasmodium falciparum cytochrome b that are associated with atovaquone resistance are located at a putative drug-binding site. Antimicrob Agents Chemother. 2000 !important; 44:2100–2108. [PubMed: 10898682]
10.Mita T, Tanabe K, Kita K. Spread and evolution of Plasmodium falciparum drug resistance. ParasitolInt. 2009; 58:201–209. [PubMed: 19393762]
11.Plowe CV. The evolution of drug-resistant malaria. Trans R Soc Trop Med Hyg. 2009 !important; 103:S11–14.[PubMed: 19084883] This article is a concise and telling account of how genetic studies have shed light on the historical spread of drug-resistant malaria, with lessons learned for the future.
12.Roper C, Pearce R, Nair S, et al. Intercontinental spread of pyrimethamine-resistant malaria. Science.2004 !important; 305:1124. [PubMed: 15326348]
13.World Health Organization. Guidelines for the treatment of malaria. Geneva: World Health Organization !important;2006.
14.Sibley CH, Barnes KI, Plowe CV. The rationale and plan for creating a World Antimalarial ResistanceNetwork (WARN). Malar J. 2007 !important; 6:118. [PubMed: 17822531]
15.Wongsrichanalai C, Pickard AL, Wernsdorfer WH, Meshnick SR. Epidemiology of drug-resistant malaria. Lancet Infect Dis. 2002 !important; 2:209–218. [PubMed: 11937421]
16.Ringwald !important; Pascal. Susceptibility of Plasmodium falciparum to antimalarial drugs: report on global monitoring. Geneva: World Health Organization; 2005. p. 1996-2004.
17.World Health Organization. Antimalarial drug combination therapy: report of a WHO technical consultation, 4–5 April 2001. Geneva: World Health Organization !important; 2001.
18.World Health Organization. World Malaria Report 2008. Geneva: World Health Organization !important; 2008.
19.World Health Organization. World Malaria Report 2009. Geneva: World Health Organization !important; 2009.
20.World Health Organization. Facts o !important;n ACTs. January 2006 Update. [February 2010]. Available athttp://rbm.who.int/cmc_upload/0/000/015/364/RBMInfosheet_9.htm
21.World Health Organization. Country antimalarial drug policies: by region. [February 2010].
22.Availableat http://www.who.int/malaria/am_drug_policies_by_region_afro/en/index.html
23.White NJ. Qinghaosu (artemisinin): the price of success. Science. 2008 !important; 320:330–334. [PubMed: 18420924]This article is an excellent review of artemisinin and the unique pharmacologic properties that make it a promising weapon in malaria elimination.
24.Sutherland C, Drakeley CJ, Obisike U, et al. The addition of artesunate to chloroquine for treatment of Plasmodium falciparum malaria in Gambian children delays, but does not prevent treatment failure. Am J Trop Hyg. 2003 !important; 69:19–25.
25.Sinclair D, Zani B, Donegan S, et al. Artemisinin-based combination therapy for treating uncomplicated malaria. Cochrane Database Syst Rev. 2009 CD007483.
26.Price RN, Nosten F, Luxemburger C, et al. Effects of artemisinin derivatives o !important;n malaria transmissibility. Lancet. 1996; 347:1654–1658. [PubMed: 8642959]
27.Nosten F, White NJ. Artemisinin-based combination treatment of falciparum malaria. Am J Trop MedHyg. 2007 !important; 77:181–192. [PubMed: 18165491]
28.Denis MB, Tsuyuoka R, Lim P, et al. Efficacy of artemether-lumefantrine for the treatment of uncomplicated falciparum malaria in northwest Cambodia. Trop Med Int Health. 2006 !important; 11:1800–1807.[PubMed: 17176344]
29.Kamya MR, Yeka A, Bukirwa H, et al. Artemether-lumefantrine versus dihydroartemisinin- piperaquine for treatment of malaria: a randomized trial. PLoS Clin Trials. 2007 !important; 2:e20. [PubMed: 17525792]
30.Sisowath C, Ferreira PE, Bustamante LY, et al. The role of pfmdr1 inPlasmodium falciparum toleranceto artemether-lumefantrine in Africa. Trop Med Int Health. 2007 !important; 12:736–742. [PubMed: 17550470]
31.Piola P, Fogg C, Bajunirwe F, et al. Supervised versus unsupervised intake of six-dose artemether- lumefantrine for treatment of acute, uncomplicated Plasmodium falciparum malaria in Mbarara, Uganda: a randomised trial. Lancet. 2005 !important; 365:1467–1473. [PubMed: 15850630]
32.Bell DJ, Wootton D, Mukaka M, et al. Measurement of adherence, drug concentrations and the effectiveness of artemether-lumefantrine, chlorproguanil-dapsone or sulphadoxine-pyrimethamine in the treatment of uncomplicated malaria in Malawi. Malar J. 2009 !important; 8:204. [PubMed: 19709418]
33.McGready R, Tan SO, Ashley EA, et al. A randomised controlled trial of artemether-lumefantrine versus artesunate for uncomplicated Plasmodium falciparum treatment in pregnancy. PLoS Med. 2008;5:e253. [PubMed: 19265453]
34.Abdulla S, Sagara I, Borrmann S, et al. Efficacy and safety of artemether-lumefantrine dispersible tablets compared with crushed commercial tablets in African infants and children with uncomplicated malaria: a randomised, single-blind, multicentre trial. Lancet. 2008 !important; 372:1819 - 1827.[PubMed: 18926569]
35.Olliaro P, Mussano P. Amodiaquine for treating malaria. Cochrane Database Syst Rev. 2003 CD000016.
36.Müller O, Sié A, Meissner P, et al. Comment o !important;n: artemisinin resistance on the Thai-Cambodian border. Lancet. 2009; 374:1419.
37.Gasasira AF, Kamya MR, Achan J, et al. High risk of neutropenia in HIV-infected children following treatment with artesunate plus amodiaquine for uncomplicated malaria in Uganda. Clin Infect Dis. 2008 !important; 46:985–991. [PubMed: 18444813]
38.Oesterholt MJ, Alifrangis M, Sutherland CJ, et al. Submicroscopic gametocytes and the transmission of antifolate-resistant Plasmodium falciparum in Western Kenya. PLoS o !important;ne. 2009; 4:e4364.[PubMed: 19194499]
39.Myint HY, Ashley EA, Daya NPJ, et al. Effiacy and safety of dihydroartemisinin-piperaquine. TransR Soc Trop Med Hyg. 2007 !important; 101:858–866. [PubMed: 17659311]
40.White NJ, Pongtavornpinyo W, Maude RJ, et al. Hyperparasitaemia and low dosing are an important source of antimalarial drug resistance. Malar J. 2009; 8:253. [PubMed: 19906307]
41.Newton PN, Fernández FM, Plançon A, et al. A collaborative epidemiological investigation into the criminal fake artesunate trade in South East Asia. PLoS Med. 2008 !important; 5:e32. [PubMed: 18271620]This article provides an eye-opening account of widespread counterfeit activities that are threatening efforts to contain artemisinin resistance.
42.Bukirwa H, Critchley J. Sulfadoxine-pyrimethamine plus artesunate versus sulfadoxine- pyrimethamine plus amodiquine for treating uncomplicated malaria. Cochrane Database Syst Rev. 2006CD004966.
43.Achan J, Tibenderana JK, Kyabayinze D, et al. Effectiveness of quinine versus artemether- lumefantrine for treating uncomplicated falciparum malaria in Ugandan children: randomized trial. BMJ. 2009; 339:b2763. [PubMed: 19622553]
44.Yeka A, Achan J, D'Alessandro U, et al. Quinine monotherapy for treating uncomplicated malaria in the era of artemisinin-based combination therapy: an appropriate public health policy? Lancet Infect Dis. 2009 !important; 9:448–442. [PubMed: 19555904]
45.World Health Organization. Global malaria control and elimination: report of a meeting o !important;n containment of artemisinin tolerance. Geneva: World Health Organization; 2008.
46.Wongsrichanalai C, Meshnick SR. Declining artesunate-mefloquine efficacy against falciparum malaria o !important;n the Cambodia-Thailand border. Emerg Infect Dis. 2008; 14:716–719. [PubMed:
47.18439351]This article summarizes the earliest evidence of artesunate-mefloquine failure o !important;n the Cambodian-Thai border and provides a critical discussion of possible factors contributing to the development of ACT resistance.
48.Vijaykadga, S.; Alker, AP.; Tongkong, D., et al. Delayed P. falciparum parasite clearance following artesunate-mefloquine combination therapy in Thailand, 1997–2007 [abstract 1119]. Presented at the American Society of Tropical Medicine and Hygiene 57th Annual Meeting !important; New Orleans, LA, USA. December 7–11. 2008
49.Lim P, Wongsrichanalai C, Chim P, et al. Decreased in vitro susceptibility of Plasmodium falciparum isolates to artesunate, mefloquine, chloroquine, and quinine in Cambodia from 2001 to 2007.Antimicrob Agents Chemother. 2010 !important; 54(5)10.1128/ AAC.01304-09
50.Dondorp AM, Nosten F, Yi Po, et al. Artemisinin Resistance in Plasmodium falciparum Malaria.
51.NEng J Med. 2009 !important; 361:455–467.This article presents the first evidence of significant artemisinin resistance in western Cambodia based on an artemisinin monotherapy trial, thus supporting earlier observations of artesunate-mefloquine failure.
52.Noedl H, Se Y, Schaecher K, et al. Evidence of artemisinin-resistant malaria in western Cambodia. NEngl J Med. 2008 !important; 359:2619–2620. [PubMed: 19064625]
53.Se, Y.; Lon, C.; Socheat, D., et al. Effects of increasing artesunate dose in seven-day monotherapy regimens o !important;n treatment response in Cambodian patients with uncomplicated falciparum malaria[abstract22]. Presented at the American Society of Tropical Medicine and Hygiene 58th Annual Meeting;Washington, DC, USA. November 18–22. 2009
54.Bethell, D.; Se, Y.; Lon, C., et al. Dose-dependent risk of neutropenia following seven-day courses of artesunate monotherapy in adult Cambodian patients with acute falciparum malaria [abstract 858].Presented at the American Society of Tropical Medicine and Hygiene 58th Annual Meeting !important; Washington, DC, USA. November 18–22. 2009
55.Karbwang J, Na-Bangchang K, Congpoung K, et al. Pharmacokinetics of oral artesunate in Thai patients with uncomplicated falciparum malaria. Clin Drug Investig. 1998 !important; 15:37–43.
56.Stepniewska K, Ashley E, Lee SJ, et al. In vivo parasitological measures of artemisinin susceptibility. J Infect Dis. 2010 !important; 201:570–9. [PubMed: 20085495]
57.Mu J, Myers RA, Jiang H, et al. Plasmodium falciparum genome-wide scans for positive selection, recombination hot spots and resistance to antimalarial drugs. Nat Genet. 2010 !important; 42:268–71. [PubMed: 20101240]
58.Olliaro P, Wells TN. The global portfolio of new antimalarial medicines under development. Clin Pharmacol Ther. 2009 !important; 85:584–595. [PubMed: 19404247] This article provides a comprehensive review of new antimalarials in the clinical and preclinical phases of development and their potential impact on malaria control and elimination.
!important;