|
Phần 2: Thay đổi cơ cấu ký sinh trùng sốt rét: rào cản kỹ thuật trong tiến trình tiến tới loại trừ sốt rét
Vai trò thuốc phối hợp ACTs trong điều trị chống kháng do P. vivax Hiện tại CQ vẫn còn nhạy với loài P. vivax, tuy nhiên tỷ lệ kháng khác nhau cũng đã được ghi nhận tại các quốc gia kể từ năm 1989 đến nay. P. vivax thường đứng thứ hai sau P. falciparum trong cơ cấu KSTSR tại nhiều vùng SRLH trên thế giới. Trước tình hình giảm nhạy và kháng như vậy, TCYTTG đã khuyến cáo sử dụng các nhóm thuốc phối hợp ACTs đối với các ca bệnh P. vivax kháng hoặc thất bại phác đồ CQ. Hơn nữa, một số BNSR có cơ địa không dung nạp với thành phần thuốc CQ, bắt buộc phải dùng thuốc khác thì lựa chọn không thuốc nào hơn chính là ACTs [35]. Từ năm 2008-2010, một số nghiên cứu từ Trung Quốc và châu Phi cũng đã tiến hành thử nghiệm các ACTs trong điều trị SR chưa biến chứng do P. vivax. Số liệu về kháng thuốc do P. vivax vẫn còn rất hạn hữu về số liệu công bố trên y văn cũng như kinh phí đầu tư cho nghiên cứu. Một vài báo cáo đăng trên y văn là có thất bại/kháng với tỷ lệ 11% tại phía nam Bình Thuận và tại Phước Thành, Bác Ái, Ninh Thuận hoặc tại Hướng Hóa, Quảng Trị và Ma Nới, huyện Ninh Sơn, tỉnh Ninh Thuận. Trong tất cả ca báo cáo kháng /thất bại lúc đó chưa phân tích và hiệu chỉnh bằng các kỹ thuật sinh học phân tử như PCR, nên con số và tỷ lệ thật sự kháng/ thất bại điều trị vẫn còn bỏ ngõ. Một nghiên cứu tiến hành so sánh hiệu lực phác đồ DHA-PPQ với CQ trong điều trị SR do P. vivax (n = 68) và hai nhóm được theo dõi liệu trình 42 ngày. Kết quả cho thấy tỷ lệ đáp ứng lâm sàng và ký sinh trùng đầy đủ là 100% ở nhóm dùng DHA-PPQ và không thấy tình trạng thất bại điều trị. Ngược lại, ở nhóm CQ cho tỷ lệ chữa khỏi là 93,55%, với 2 ca thất bại KST muộn vào ngày D28 và D42. Tỷ lệ thất bại này tương tự như nghiên cứu tại Ninh Thuận với tỷ lệ chữa khỏi P. vivax là 94,3% và thất bại KST muộn là 5,7% xem như cảnh báo sớm hoặc đã giảm nhạy thông qua thời gian sạch KST và thời gian cắt sốt kéo dài [5],[74]. Điểm phức tạp với SR do P. vivax là tình trạng thể ngủ trong gan tái hoạt động sau thời gian điều trị sẽ rất khó phân biệt tái phát - tái nhiễm trên ca bệnh do đang ở vùng SRLH nặng với các cơn tái nhiễm liên tục sẽ khó loại trừ. 
Hình 1
Nghiên cứu này cho tỷ lệ thất bại thấp (6,45%) so với một số nghiên cứu thực hiện gần đây tại Thái Lan, Indonesia và Myanmar từ năm năm qua. Nhìn chung, trong tuần đầu theo dõi thì đều sạch KST và thời điểm xuất hiện lại KST P. vivax là trong khoảng từ D21 đến D28. Tuy nhiên, do đặc tính sinh học trong chu kỳ sinh bệnh của loài P. vivax, thể ngủ có khoảng thời gian “ngủ đông” có thể dài ngắn khác nhau, có thể dao động từ vài tuần đến vài năm, có thể tái phát sớm lúc 16 ngày và có thể muộn hơn là trên 3 năm kể từ lần nhiễm đầu tiên, nên các trường hợp xuất hiện lại KST vào thời điểm nào trong suốt quá trình theo dõi cũng cần làm sáng tỏ bằng sinh học phân tử và đo nồng độ thuốc tại thời điểm xuất hiện lại KST, để xem đó là tái phát hay tái nhiễm và đây là điểm khó nhất trong đánh giá nhạy kháng của P. vivax vìkhi phân tích kiểu gen thì có đến hơn ½ số trường hợp có KST gây tái phát lại có kiểu gen khác với kiểu gen nhiễm ban đầu. Qua phân tích hiệu lực cắt sốt và cắt KST từng phác đồ DHA-PPQ và CQ, cho biết thời gian cắt sốt lần lượt ở nhóm dùng DHA-PPQ và CQ là đều dưới 36 giờ. Thời gian làm sạch ký sinh trùng ở hai nhóm DHA-PPQ và CQ có sự khác biệt, lần lượt 38,12 ± 12,20 giờ và 62,24 ± 12,24 giờ (p < 0,01). Điểm thú vị trong nghiên cứu này là vai trò của từng phác đồ trong kiểm soát và làm giảm khả năng tái phát (xuất hiện lại) và nhiễm mới (một đợt nhiễm mới có thể cùng loài hoặc khác loài), đặc biệt vai trò của từng nhóm thuốc tác động có ý nghĩa trên bệnh nhân P. vivax. Mặc dù vấn đề này các nghiên cứu cơ bản và chuyên sâu gần đây báo cáo trên mạng lưới kháng thuốc toàn cầu của TCYTTG vẫn chưa thể lý giải đầy đủ lý do tại sao và nhân tố nào kích thích vào tái hoạt thể ngủ dẫn đến tái phát [81]. Dù các phác đồ thuốc DHA-PPQ và CQ, trong thành phần không có chất nào có hoạt tính chống và diệt thể hữu tính (giao bào), song hầu hết các nghiên cứu về dược động học về artemisinin đều cho thấy thuốc tác động nhanh trên cả P. vivax và P. falciparum, đặc biệt diệt nhanh thể tư dưỡng và phân liệt từ giai đoạn còn non đến trưởng thành, do vậy nó cũng gián tiếp cắt giảm nhanh thể giao bào đáng kể. 
Hình 2
Nghiên cứu tại Afghanistan thử nghiệm lâm sàng ngẫu nhiên có đối chứng, so sánh hiệu lực CQ với DHA-PPQ trên các BNSR nhiễm P. vivax tuổi từ 3 tháng trở lên. Các đối tượng được theo dõi mỗi ngày trong 4 ngày đầu và mỗi tuần sau đó cho đến ngày thứ 56.Điểm kết thúc là tỷ lệ thất bại KST tính tích lũy đến D56 kể từ khi bắt đầu điều trị với giả thuyết DHA-PPQ không ưu thế hơn so với CQ, kết quả cho thấy trong số 2.182 bệnh nhân P. vivax, 536 ca được đưa vào thử nghiệm. Tỷ lệ chữa khỏi vào ngày 28 cả hai phác đồ là 100%. Tỷ lệ sạch KST ở nhóm DHA-PPQ nhanh hơn CQ. Vào ngay D56, tái phát nhóm CQ là 8,9% cao hơn so với DHA-PPQ là 2,8%. Phân tích đường cong Kaplan-Meier cho thấy DHA-PPQ ưu thế hơn CQ. Với dữ liệu trên cho thấy DHA-PPQ còn có nhiều ưu điểm vượt trội so với CQ về khía cạnh làm sạch KST cả về thời gian và tốc độ, cũng như tác động trên giao bào. Hiệu lực ACPR cao cùng với thời gian cắt sốt và làm sạch KST P. vivax nhanh trong máu cũng như tốc độ làm cải thiện lâm sàng lẫn cận lâm sàng như thế, kết quả nghiên cứu cũng đã chứng minh hiệu lực CQ vẫn còn bền vững và đạt tiêu chí TCYTTG đặt ra, chưa phải đổi chiến lược thuốc. Dù hiệu lực còn bền vững, song một số ca thất bại KST muộn cũng cho thấy có vẻ giảm nhạy của P. vivax. Do đó, bằng chứng về thời gian sử dụng dài cũng như lượng thuốc như thế sẽ gây tăng áp lực trên quần thể P. vivax, từ tăng áp lực đến giảm nhạy và kháng thuốc sẽ không xa nếu chúng ta không có giám sát hiệu lực phác đồ. Một số định nghĩa và thuật ngữ liên quan đến kháng thuốc sốt rét Về định nghĩa, kháng thuốc là khả năng của một chủng KSTSR sống sót hoặc nhân lên dù đã chỉ định một liều thuốc hợp lý và bản thân bệnh nhân có hấp thu thuốc bình thường. Kháng với một thuốc có thể là một hậu quả liên quan đáp ứng giữa nồng độ-hiệu quả thuốc đó. Vì đặc tính dược động học của thuốc thay đổi rất rộng giữa các bệnh nhân với nhau, khi xét về định nghĩa của kháng thuốc SR cũng có khi gặp phải trường hợp nồng độ thuốc trong huyết tương bình thường vì chúng còn liên quan chuyển hóa, phân bố, thải trừ thuốc trong cơ thể. Kháng thuốc (drug resistance) không nhất thiết luôn xem nó như một ca thất bại điều trị (treatment failure) nghĩa là thất bại với việc làm sạch KST trong máu và/ hoặc giải quyết các triệu chứng lâm sàng khi đã chỉ định thuốc đúng. Do vậy, trong khi kháng thuốc ắt sẽ dẫn đến thất bại điều trị, nhưng không phải tất cả trường hợp thất bại điều trị đều là do kháng thuốc. Thất bại điều trị có thể do sử dụng liều không đúng, tuân thủ điều trị của bệnh nhân, chất lượng thuốc kém, tương tác giữa các thuốc, hấp thu thuốc kém, hoặc chẩn đoán nhầm bệnh. Hiện tại, kháng thuốc diễn biến rất phức tạp, nên việc giám sát cần xem như một công việc thường quy để theo dõi xuất hiện cũng như quy mô lan rộng là cần thiết. Hiện nay, TCYTTG xác nhận có 3 trong 5 loài Plasmodium spp. gây bệnh ở người kháng thuốc là P. falciparum, P. vivax và P. malariae (WHO, 2015) và đưa ra các định nghĩa, thuật ngữ làm rõ trong thực hành lâm sàng và nghiên cứu: -Áp lực chọn lọc: kháng với thuốc sốt rét xuất hiện và lan rộng vì lợi điểm sống sót có chọn lọc mà các KSTSR kháng có mặt trong sự có mặt của thuốc SR mà ở đó chúng kháng lại. Áp lực chọn lọc mô tả cường độ và độ lớn của tiến trình chọn lọc. Tỷ lệ của các KST trong một quần thể KST biết trước phơi nhiễm với nồng độ một thuốc SR mà cho phép phát triển kháng, nhưng KST còn nhạy càng lớn thì áp lực chọn lọc càng lớn; -Kháng thuốc: khả năng 1 chủng còn sống sót hoặc nhân lên dù được chỉ định liều đủ hoặc cao hơn liều khuyến cáo trong dung nạp cơ thể (WHO, 1967); -Thất bại điều trị: là tình trạng không có khả năng làm sạch KSTSR trong máu hoặc cải thiện triệu chứng lâm sàng dù đã chỉ định thuốc (WHO, 2012). Tuy nhiên, không phải thất bại điều trị luôn luôn do kháng thuốc mà có thể do nhiều yếu tố, chủ yếu là do nồng độ thấp và dung nạp thuốc từ KSTSR đó; -Tái nhiễm hoặc nhiễm mới: là một ca bệnh mới nhiễm một đợt mới của KSTSR do muỗi truyền bệnh có thoi trùng; -Tái phát xa: là giai đoạn P. vivax hoặc P. ovale còn tồn tại trong tế bào gan, sau đó tự bùng phát trở lại, gây lên tái hoạt động và xuất hiện lại trong máu; -Tái phát sớm: là tình trạng bệnh tái xuất hiện sau thời gian yên lặng hay sự tái hồi, thường đề cập đến P. falciparum. -Plasmodium vivax kháng CQ được xác định, phân loại (WWARN, 2015): +Phân loại 1: Trên 10% số ca xuất hiện lại KSTSR đến ngày 28 với khoảng tin cậy CI 95%, ước tính kháng > 5%, bất luận xác định nồng độ thuốcchloroquin và chất chuyển hóa desethylchloroquin (CQ+DCQ) trong máu đầy đủ. Nguy cơ kháng có thể lớn hơn 10% nếu cỡ mẫu đủ lớn; +Phân loại 2: Xác định tái xuất hiện KSTSR trong 28 ngày với nồng đồ thuốc trong máu > 100nM. Sự phát triển KST ở nồng độ thuốc (CQ+ DCQ) cao sẽ các định kháng cao; +Phân loại 3: Trên 5% số ca xuất hiện lại KSTSR đến ngày 28 với khoảng tin cậy CI 95%, ước tính kháng < 5%, bất luận xác định nồng độ thuốc (CQ+DCQ) trong máu đầy đủ. Bằng chứng này cho kháng CQ, có thể phản ánh các yếu tố khác như chất lượng thuốc hoặc hấp thu thuốc kém; +Phân loại nhạy với CQ: xác định độ nhạy đòi hỏi đủ các tiêu chí: các bệnh nhân đưa vào nghiên cứu có triệu chứng lâm sàng, tái xuất hiện KSTSR < 5% đến ngày 28, không dùng thuốc primaquin trong vòng 28 ngày và cỡ mẫu ít nhất 10 bệnh nhân. Một số yếu tố thuận lợi cho ký sinh trùng sốt rét phát triển kháng Quá trình phát triển kháng thuốc có thể chia thành hai phần: Một là các yếu tốdi truyền phát sinh và hình thành các đột biến kháng và thứ hai là quá trình chọn lọc kháng do lan truyền đột biến, nên kháng sẽ lan rộng. Nếu không có kháng thuốc, các đột biến kháng ở các phân lập có thể có bất lợi về mặt sống sót và gia tăng áp lực thuốc. Kháng với một thuốc có thể chọn lọc kháng với một thuốc khác hay gọi là kháng chéo. Thuốc kháng ở một giai đoạn của KSTSR thường dẫn đến kháng các giai đoạn khác, khi đã kháng thì chúng có khả năng duy trì, dễ phát sinh kháng chéo trong cùng một nhóm thuốc hoặc có khả năng gây cho muỗi tăng nhiễm chủng KST kháng. Nguyên nhân có thể dẫn đến phát triển KSTSR kháng thuốc [10],[64]: -Áp lực thuốc: khi dùng 1 loại thuốc trong 1 thời gian dài ở phạm vi rộng vùng SRLH cao, sẽ tạo điều kiện thuận lợi cho chủng biến dị, kháng tự nhiên dần nhân lên, thay thế những chủng nhạy bị diệt từ từ (quá trình sàng lọc cạnh tranh do áp lực thuốc). Gen nhạy và gen kháng là một phức hợp đã được chứng minh rằng nếu đơn dòng thì sẽ có đáp ứng khác nhau (dòng nhạy/ dòng kháng). Khi dùng một thuốc thời gian dài không kiểm soát, không đủ liều mà mật độ KSTSR cao sẽ khó tiệt căn, thì KSTSR dễ thích nghi dần với thuốc; -Sinh thái người di biến động: KSTSR thường phát sinh và phát triển ở những nơi có nhiều nguồn bệnh, mật độ KSTSR cao ở quần thể chưa có miễn dịch mới vào vùng SRLH nặng có thể làm KSTSR kháng thuốc lan rộng; -Sự đột biến gen, đột biến phân tử KSTSR cũng gây ra kháng thuốc. Tần suất thay đổi nội sinh về mặt di truyền xảy ra khi phát triển của KSTSR; -Mức độ kháng thay đổi do đột biến di truyền cũng như thay đổi cơ chế kháng; -Tỷ lệ và số lượng KSTSR phơi nhiễm với TSR cũng như nồng độ của TSR mà tại thời điểm đó KSTSR đã phơi nhiễm; -Đặc tính về dược động học, dược lực học và chất lượng của thuốc -Về mặt bệnh nhân (liều lượng, thời gian, tuân thủ điều trị) cũng như mô hình dùng thuốc trong vùng. Sự xuất hiện đồng thời các thuốc khác có hay không có đặc tính chống KSTSR và sự tương tác qua lại giữa các thuốc đó khi dùng trên cùng bệnh nhân. Một nghiên cứu tiến hành chọn tất cả xã thuộc huyện Krông Pa, tỉnh Gia Lai (thuộc Tier 1 vùng xác định có P. falciparum kháng thuốc artemisinin). Tổng số 14 xã, thị trấn, 132 thôn, buôn; 15.850 hộ, diện tích toàn huyện 1628,14 Km2, dân số gần 83.000 người, chủ yếu dân tộc bản địa Gia Rai (80%). Đây là một huyện nằm ở phía tây namtỉnhGia Lai, phía Bắc giáp huyện Đồng Xuân (tỉnh Phú Yên), phía Nam giáp huyện Ea Kar (tỉnh Đăk Lăk), phía Đông giáp huyện Sơn Hòa, Sông Hinh (tỉnh Phú Yên), phía Tây giáp huyện Ea Hleo, Krông Năng (tỉnh Đăk Lăk), Sông Ba chảy giữa huyện theo hướng tây bắc - đông nam. Huyện có thị trấn Phú Túc và 13 xã Uar, Ia Rsiơm, Ia Rmok, Chư Rcăm, Ia Dreh, Krông Năng, Ia Rsai, Chư Drăng, Ia Mlah, Chư Gu, Đất Bằng, Phú Cần, Chư Ngọc. Địa bàn huyện Krông Pa có nhiều công trình xây dựng và thủy điện dọc theo quốc lộ 25, từ đèo Tô Na đến cầu Kà Lúi.. Hầu hết xã thuộc vùng SRLH nặng có mặt các loài ký sinh trùng Plasmodium spp. song chủ yếu P. falcipparum và P. vivax chiếm cao trong cơ cấu, đồng thời là vùng sốt rét trọng điểm của tỉnh Gia Lai và khu vực miền Trung-Tây Nguyên. Đây là một điểm sentinel nghiên cứu P. falciparum kháng thuốc từ năm 2010 đã cho thấy hiệu lực thuốc artesunate đơn trị liệu 7 ngày với đáp ứng lâm sàng và ký sinh trùng dưới 90%, tái xuất hiện lại ký sinh trùng trong vòng 28/42 ngày trên 15%, hoặc đáp ứng lâm sàng và ký sinh trùng với DHA-PPQ đối với P. falciparum còn bền vững nhưng bắt đầu có một tỷ lệ D3 dương tính khoảng 40%. Liên quan đến hiệu lực của P. vivax đối với CQ tuy có thử nghiệm đánh giá nhưng không liên tục, nên khoảng trống số liệu chưa đánh giá toàn diện. Địa bàn huyện cách thành phố Pleiku khoảng 180km, với nhiều xã có tình hình sốt rét diễn biến phức tạp. Mùa truyền bệnh sốt rét hàng năm vào tháng 7-10 và 12-01 năm sau (thời điểm dân đi làm rẫy và thu hoạch, cũng như làm theo mùa), với số liệu BNSR và KSTSR trong giai đoạn từ 2012-2016 cho thấy số ca cũng chiếm cao nhất so với các vùng khác trong tỉnh, đặc biệt tỷ lệ P. falciparum và P. vivax có xu hướng đảo nghịch hoặc tương đương 50%. Bệnh nhân chủ yếu là nam giới, tuổi trưởng thành và đang sống hoặc có giao lưu trong vùng SRLH, thường vào các khu vực trồng rừng, rẫy làm mì, trồng bắp, trồng ớt, đậu xanh, lấy gỗ, lan rừng, măng rừng và mật ong, bẫy thú rừng. Chưa thấy hiện tượng dân giao lưu biên giới với các quốc gia (Campuchia, Lào), nhưng dân ở xã Ia R’ Căm thường vào vùng lòng hồ thủy lợi, suối nước chảy chậm và nước đọng hồ Tân Túc, nên thường nhiễm sốt rét tại bìa rừng và vùng này. Do hầu hết người dân khi sốt thường hay chuyển thẳng lên BVĐK huyện Krông Pa, nên nhóm nghiên cứu sẽ đóng tại hai điểm (xã và trung tâm huyện) để thu thập bệnh nhân đủ cỡ mẫu yêu cầu. Trong thời gian tiến hành nghiên cứu từ năm 2016-2017, nhóm nghiên cứu đã thu thập số liệu thông qua các hồ sơ, báo cáo từng tháng, từng quý, báo cáo 6 tháng và báo cáo tổng kết sốt rét các năm cũng như số liệu về nghiên cứu in vivo đánh giá hiệu lực phác đồ thuốc chloroquin trong điều trị sốt rét chưa biến chứng do P. vivax, xin ghi nhận một số kết quả sau: Tình hình bệnh nhân sốt rét tại huyện Krông Pa, tỉnh Gia Lai 2012-2016 Trong thời gian 5 năm (2012-2016), tổng số 8.448 bệnh nhân sốt rét ở toàn huyện Krông Pa, tỉnh Gia Lai ghi nhận thông qua thông tin hồ sơ báo cáo sốt rét tại Trung tâm y tế huyện, Bệnh viện đa khoa huyện và các trạm y tế xã trực thuộc đến khám, xét nghiệm máu sàng lọc, phát hiện thụ động (bệnh nhân tự đến bệnh viện điều trị) lẫn chủ động (phát hiện ca bệnh tại nhà trong thôn, buôn của các xã đưa về bệnh viện điều trị) bằng xét nghiệm lam máu nhuộm giêm sa và test chẩn đoán nhanh SD-Bioline P.f/P.v pLDH/HRP2 antigen tại các tuyến. Số bệnh nhân sốt rét được phân tích theo loài Plasmodium spp. và phân theo từng tháng trong năm từ năm 2012-2016 Tình hình chung bệnh nhân sốt rét toàn huyện Krông Pa, tỉnh Gia Lai Bảng 3.1. Tình hình bệnh nhân sốt rét phân bố theo từng tháng (2012-2016) Năm | Phân bố bệnh nhân theo từng tháng trong năm 2012- 2016 | Tổng | T1 | T2 | T3 | T4 | T5 | T6 | T7 | T8 | T9 | T10 | T11 | T12 | 2012 | 161 | 141 | 77 | 52 | 55 | 96 | 95 | 90 | 90 | 216 | 386 | 306 | 1765 | 2013 | 158 | 96 | 60 | 46 | 53 | 92 | 115 | 201 | 376 | 345 | 227 | 235 | 2004 | 2014 | 156 | 91 | 64 | 49 | 50 | 67 | 59 | 81 | 345 | 328 | 387 | 514 | 2191 | 2015 | 299 | 185 | 109 | 75 | 59 | 50 | 39 | 81 | 345 | 328 | 387 | 514 | 2471 | 2016 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 5 | 7 | 0 | 17 | Tổng | 774 | 513 | 310 | 222 | 217 | 305 | 308 | 453 | 1161 | 1222 | 1394 | 1569 | 8448 |

Hình 3.1. Tình hình bệnh nhân sốt rét phân bố theo từng tháng tại huyện Krông Pa (2012-2016)
Nhận xét: Tổng số bệnh nhân sốt rét trong 5 năm (2012-2016) là 8448 ca, trong đó năm 2012 là 1765 ca, năm 2013 có 2004 ca, năm 2014 có 2191 ca, năm 2015 là 2471 ca và năm 2016 là 17 ca. Số bệnh nhân sốt rét phân bố tương đối đều ở các tháng từ tháng 4 đến tháng 9 hàng năm, riêng từ tháng 10 đến tháng 2 năm sau có xu hướng tăng cao. Bảng 3.2. Phân bố bệnh nhân sốt rét theo các xã trong huyện (2012-2016) TT | Tên xã | Phân bố ca bệnh theo xã( 2012 - 2016) | Tổng số | 2012 | 2013 | 2014 | 2015 | 2016 | 1 | Ia RSai | 111 | 163 | 172 | 155 | 1 | 602 | 2 | Ia RSiêm | 73 | 161 | 105 | 99 | 10 | 448 | 3 | Chư Rcăm | 301 | 263 | 257 | 248 | 1 | 1070 | 4 | Phú Cần | 107 | 163 | 139 | 157 | 0 | 566 | 5 | KRông Năng | 38 | 38 | 61 | 84 | 0 | 221 | 6 | Phú Túc | 89 | 65 | 93 | 108 | 0 | 355 | 7 | Đất Bằng | 213 | 139 | 198 | 239 | 2 | 791 | 8 | Chư Gu | 298 | 215 | 266 | 295 | 0 | 1074 | 9 | Chư Ngọc | 64 | 142 | 129 | 124 | 0 | 459 | 10 | Ia Rmok | 108 | 130 | 167 | 231 | 1 | 637 | 11 | Ia Mláh | 129 | 207 | 141 | 122 | 0 | 599 | 12 | Chư Drăng | 56 | 70 | 61 | 81 | 0 | 268 | 13 | Uôr | 61 | 105 | 151 | 180 | 1 | 498 | 14 | Ia Dreh | 149 | 143 | 251 | 348 | 1 | 892 | | Tổng số | 1797 | 2004 | 2191 | 2471 | 17 | 8448 |

Hình 3.2. Phân bố bệnh nhân sốt rét theo từng xã trong huyện từ (2012-2016)
Nhận xét: Bệnh nhân sốt rét phân bố đều ở 14 xã và thị trấn Phú Túc của toàn huyện Krông Pa, tỉnh Gia Lai. Trong đó, số bệnh nhân sốt rét tập trung nhiều nhất là xã Chư Gu (1.074 ca), xã Chư R’Căm (1.070 ca), xã Ia D’reh (892 ca), xã Ia R’mok (637 ca), Ia Sai (602 ca), xã Ia M’lah (599 ca) và xã Phú Cần (566 ca). Các xã còn lại có số ca mắc dưới 500 ca. Tổng số ca bệnh có xu hướng tăng dần theo từng năm từ 2012 (1979 ca), năm 2013 có ghi nhận 2004 ca, năm 2014 có 2191 ca, năm 2015 có 2417 ca và đến năm 2016 chỉ còn là 17 ca. Đặc điểm cơ cấu ký sinh trùng sốt rét trong thời gian 2012-2016 Bảng 3.3. Đặc điểm chung về bệnh nhân sốt rét Plasmodium spp. (2012-2016) Nội dung phân tích | Thời gian (2012-2016) | Số lượng | Tỷ lệ (%) | Cơ cấu KSTSR Plasmodium spp. P. falciparum P. vivax P. malariae P. falciparum + P. vivax | 4190 4059 01 198 | 49,6% 48,08% 0,01% 2,34% | Tổng số | 8448 | 100% |
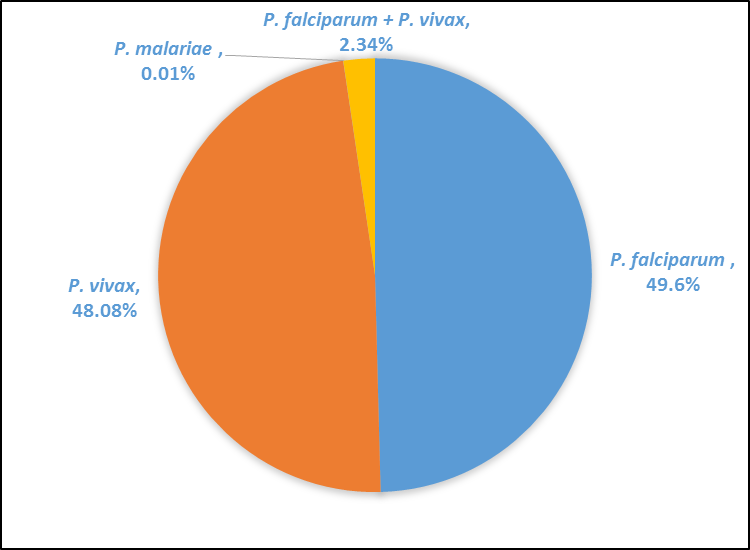
Hình 3.3. Cơ cấu ký sinh trùng sốt rét Plasmodium spp. giai đoạn (2012-2016)
Nhận xét: Trong cơ cấu ký sinh trùng sốt rét của giai đoạn 2012-2016 cho thấy số ca nhiễm đơn loài P. falciparum là 4190 ca chiếm 49,6%, trong khi đó số ca nhiễm đơn loài P. vivax là 4059 ca, chiếm 48,08%. Số còn lại là 198 ca nhiễm phối hợp P. falciparum và P. vivax (2,34%) và rất ít ca nhiễm đơn loài P. malaria là 01 ca (0,01%) Bảng 3.4. Cơ cấu ký sinh trùng sốt rét Plasmodium spp. từ năm 2012-2016 Cơ cấu KSTSR Plasmodium spp. | Thời gian 2012-2016 | 2012 | 2013 | 2014 | 2015 | 2016 | P. falciparum | 1102 | 969 | 1051 | 1063 | 5 | P. vivax | 563 | 971 | 1124 | 1389 | 12 | P. malariae | 0 | 0 | 0 | 1 | 0 | P. fal + P. viv | 100 | 64 | 16 | 18 | 0 | Tổng số | 1797 | 2004 | 2191 | 2471 | 17 |

Hình 3.4. Tỷ lệ từng loài ký sinh trùng sốt rét tại Krông Pa (2012-2016)
Nhận xét: Với số liệu ở trên có thể cho thấy chỉ có năm 2012, số ca nhiễm P. vivax cao gần gấp đôi so với nhiễm P. falciparum (1102 ca so với 563 ca) trong cơ cấu ký sinh trùng sốt rét. Giai đoạn từ năm 2013-2016 thì số ca nhiễm hai loài này gần tương đương nhau. Từ năm 2013 đến năm 2015, số ca nhiễm đơn loài P. falciparum lần lượt là 969 ca, 1051 ca và 1063 ca tương đương với số ca nhiễm P. vivax đơn loài lần lượt là 971 ca, 1124 ca và 1389 ca theo các năm 2013, 2014 và 2015. Đặc điểm chung của quần thể và nhóm bệnh nhân tham gia nghiên cứu Trong thời gian tiến hành nghiên cứu từ năm 2016-2017, nhóm nghiên cứu đã thu thập số liệu thông qua hồi cứu các hồ sơ, báo cáo từng tháng, từng quý, báo cáo 6 tháng và báo cáo tổng kết sốt rét các năm từ 2012-2016 cũng như số liệu về nghiên cứu in vivo đánh giá hiệu lực phác đồ thuốc chloroquin trong điều trị sốt rét chưa biến chứng do P. vivax (2016-2017). Số liệu hồi cứu trong thời gian 5 năm (2012-2016) cho thấy có tổng số 8.448 bệnh nhân sốt rét ở toàn huyện Krông Pa, tỉnh Gia Lai ghi nhận thông qua thông tin hồ sơ báo cáo sốt rét tại Trung tâm Y tế huyện, Bệnh viện đa khoa huyện và các trạm y tế xã, phòng khám khu vực hay liên xã trực thuộc đến khám, xét nghiệm máu sàng lọc, phát hiện thụ động lẫn chủ độngbằng xét nghiệm lam máu nhuộm giêm sa chuẩn vàng và bằng các test chẩn đoán nhanh phát hiện kháng nguyên Pf/Pv pLDH/HRP2 (loại Care-Start Malaria pLDH/HRP2 và test SD-Bioline P.f/P.v pLDH/HRP2 antigen) tại các tuyến điều trị cho thấy: Tình hình chung bệnh nhân sốt rét toàn huyện Krông Pa, tỉnh Gia Lai Tổng số bệnh nhân sốt rét trong 5 năm (2012-2016) là 8.448 ca, trong đó năm 2012 là 1.765 ca, năm 2013 có 2.004 ca, năm 2014 có 2.191 ca, năm 2015 là 2.471 ca và năm 2016 còn chỉ 17 ca. Dữ liệu về số bệnh nhân sốt rét phân bố tương đối đều ở các tháng từ tháng 4 đến tháng 9 hàng năm, riêng từ tháng 10 năm này đến tháng 2 năm kế tiếp có xu hướng tăng cao. Điều này, phần lớn có thể do vào dịp cuối năm có các mùa vụ thu hoạch mì, bắp và nông sản khác ở địa bàn huyện, nên một số chủ vựa thuê nhân công, người lao động tập trung vào các trọng điểm rẫy để khai thác và thu hoạch theo mùa vụ, hoặc nhóm nam lao động đi vào rừng khai thác lâm thổ sản, lấy măng, đậu xanh, lấy gỗ quý bán. Đồng thời, có một số người đi vào rừng lấy mai, phong lan để phục vụ vào dịp tết nguyên đáng. Bên cạnh đó, trên địa bàn một số xã trong huyện còn có các công trình thủy điện - thủy lợi rông khắp phục vụ tưới tiêu và cung ứng điện nên cũng tập trung nhiểu công nhân tham gia và dễ phơi nhiễm với sốt rét (thủy điện ở xã Ia M’lah, xã Uôr, xã Phú Cần), tình trạng ngủ rẫy và canh tác theo mùa hay thuê mướn nhân công theo thời hạn, dân di biến động trong cùng huyện hoặc ra các huyện lân cận trở về, nhất là mùa khô gần dịp tết đi rẫy dài ngày, làm mì và cắt mì phơi tại chỗ vào ban đêm tại rẫy đã tạo điều kiện mắc sốt rét cao ở huyện. Do đó, số ca sốt rét trong giai đoạn này tăng cao hơn so với các tháng còn lại. 
Hình 4
Gia Lai nói chung và huyện Krông Pa là một trong hai tỉnh của toàn quốc luôn có số ca mắc sốt rét cao qua các năm. Bệnh nhân sốt rét báo cáo trong bảng số liệu dừơng như phân bố đều ở 14 xã và thị trấn Phú Túc của huyện Krông Pa, tỉnh Gia Lai. Trong đó, bệnh nhân sốt rét tập trung nhiều nhất là xã dọc theo đường tỉnh lộ từ thành phố Pleiku và huyện Ajunpa, Iapa đổ về trung tâm thị trấn huyện như xã Chư Gu (1.074 ca), xã Chư R’Căm (1.070 ca), xã Ia Dreh (892 ca), xã Ia Mlah (599 ca) và xã Phú Cần (566 ca) theo các năm. Tổng số ca bệnh có xu hướng tăng dần mặc dù các cơ quan, ban ngành cùng ra quân và đẩy mạnh công tác phòng chống sốt rét, đặc biệt là Viện Sốt rét-KST-CT Quy Nhơn thường xuyên có cán bộ túc trực ở các điểm nóng để hỗ trợ công tác giám sát dịch tễ học, chẩn đoán và theo dõi điều trị và quản lý ca bệnh, theo từng năm từ năm 2012 (1.979 ca), năm 2013 có ghi nhận 2.004 ca, năm 2014 có 2.191 ca, đến năm 2015 vẫn còn 2.417 ca và đến năm 2016 chỉ còn là 17 ca. Điểm chung là hầu hết bệnh nhân là dân tại chỗ, dân tộc bản địa Gia Rai của các xã nói trên, thường ngày làm nghề nghiệp nông rẫy và tự do, khi vào vụ mùa thì các chủ vựa hay rẫy lớn thuê làm nhân công theo vụ, có khi ở lại trong rẫy cả tuần hay 10 ngày đến khi đưa sản phẩm thu hoạch ra ngoài. Mặc dù, được các dự án đầu tư rất nhiều kinh phí vào hầu hết các biện pháp phòng chống từ giám sát ca bệnh, điều tra ca bệnh cụ thể, cấp màng, một số võng có bọc võng có tẩm hóa chất tồn lưu kéo dài (LLINs) cho nhóm nguy cơ và đi rừng ngủ rẫy, song độ bao phủ nằm màng hay võng có bọc võng không phải lúc nào điều tra cũng cho tỷ lệ 100%, nên dễ có nguy cơ phơi nhiễm sốt rét khi họ đi rẫy và rừng ở lại qua đêm là khó tránh khỏi. Đặc điểm cơ cấu ký sinh trùng sốt rét trong thời gian 2012-2016 Trong cơ cấu ký sinh trùng sốt rét của giai đoạn 2012-2016 cho thấy số ca nhiễm đơn loài P. falciparum là 4.190 ca chiếm 49,6%, trong khi đó số ca nhiễm đơn loài P. vivax với 4059 ca, chiếm 48,08% tương đương với tỷ lệ P. falciparum. Số ca sốt rét còn lại là 198 ca nhiễm phối hợp hai loài P. falciparum và P. vivax (2,34%) và chỉ ghi nhận 1 ca nhiễm đơn thuần loài P. malaria (0,01%). Do đó, nếu tính tổng thể trong giai đoạn từ năm 2012-2016, số ca nhiễm P. vivax có xu hướng cao gần tương đương so với nhiễm P. falciparum trong cơ cấu ký sinh trùng sốt rét. Số liệu này so sánh với một số huyện thuộc tỉnh khác trong khu vực miền Trung-Tây Nguyên như Ninh Thuận, Phú Yên Khánh Hòa, Đăk Lăk, Đăk Nông trong cùng giai đoạn cũng cho kết quả có sự dịch chuyển cơ cấu ký sinh trùng tương tự và không phải liên tục, vì có năm số ca P. vivax cao hơn có năm số ca P. falciparum. 
Hình 5
Phân tích chi tiết số liệu từng năm của toàn huyện cho thấy chỉ có năm 2012 là số ca nhiễm đơn thuần P. falciparum còn cao gần gấp đôi so với số ca nhiễm đơn loài P. vivax (1.102 ca P. falciparum so với 563 ca P. vivax). Song từ năm 2013, 2014 và đến năm 2015, số ca nhiễm P. falciparum lần lượt là 969 ca, 1051 ca và 1063 ca tương đương với số ca nhiễm P. vivax lần lượt là 971 ca, 1124 ca và 1389 ca, tỷ lệ giữa hai loài gần giá trị 1 (969/971 năm 2013, 1051/1124 năm 2014 và 1063/1389 năm 2015). So với giai đoạn 10 năm trước đó trong toàn khu vực thì tỷ lệ nhiễm P. falciparum luôn luôn cao hơn rất nhiều lần so với P. vivax [9],[10],[ Tại Việt Nam, cơ cấu KSTSR này cũng đi theo chiều hướng đó từ năm 2010-2015, tỷ lệ P. vivax có xu hướng “đảo cực” tiến gần đến tương đương, thậm chí cao hơn P. falciparum tại một số huyện thuộc vùng sốt rét trọng điểm, có lan truyền cao 11],[12], trong đó đặc biệt đáng chú ý từ năm 2010 số liệu tổng kết toàn quốc về sốt rét đã cho thấy cơ cấu ký sinh trùng bắt đầu thay đổi với tỷ lệ P. falciparum chung toàn quốc là 61% (10.101/16.612) nhưng khác nhau giữa các khu vực: khu vực miền Bắc P. falciparum chiếm 36,5% (233/638), khu vực ven biển miền Trung 61,7% (3535/5724), khu vực Tây Nguyên 67,9% (4080/6010), khu vực Đông Nam Bộ là 52,2% (1928/3688), khu vực đồng bằng sông Cửu Long 58,9% (325/552) và nhận định dù khác nhau theo từng vùng nhưng cơ cấu KSTSR hiện nay đã có chiều hướng thay đổi với P. vivax có phần trội hơn trước đây, chiếm 34% (so với năm 2010, tỷ lệ này chỉ có 25%). So sánh nghiên cứu này với số liệu về cơ cấu ký sinh trùng sốt rét trong toàn tỉnh Gia Lai cũng như các tỉnh Tây Nguyên vào năm 2010, khi đó cũng cho thấy chưa có sự đảo cực với tổng số ca là 1869, trong đó P. falciparum cao hơn gấp 5,42 lần so với P. vivax (1566/289), tương tự tại các tỉnh khác như Đăk Lăk có P. falciparum cao gấp 7,16 lần so với P. vivax (1038/145), tại Kon Tum có P. falciparum cao gấp 4,75 lần so vớ P. vivax (418/88), tại Đăk Nông có P. falciparum cao gấp 2,47 lần so vớ P. vivax (465/188). Tương tự, so sánh với số liệu tại các tỉnh ven biển miền Trung cũng cho thấy chưa có sự chuyển dịch cơ cấu năm 2010, cụ thể tại Quảng Bình có P. falciparum cao gấp 7,6 lần so vớ P. vivax (266/35), hay tỷ lệ này cao gấp 10,9 lần (774/71) tại Quảng Trị; 2,56 lần (46/18) tại Thừa Thiên Huế; 2,28 lần (1957/860) tại Quảng Nam; 1,75 lần (131/75) tại Quảng Ngãi; 2,15 lần (181/84) tại Bình Định; 4,29 lần (300/70) tại Phú Yên; 3,1 lần (921/299) tại Khánh Hòa; 4,16 lần (891/214) tại Ninh Thuận và 1,14 lần (389/253) tại Bình Thuận. Số liệu trên đều cho thấy các tỉnh trong khu vực miền Trung-Tây Nguyên đều có số ca mắc P. falciaprum cao hơn từ 1,14 -10,9 lần so với P. vivax. So sánh với một số tỉnh khu vực Nam bộ-Lâm Đồng cũng cho số liệu tưng tự như tại Bình Phước, P. falciparum cao gấp 2,14 lần so với P. vivax (1869/873) hay tại Lâm Đồng có P. falciparum cao gấp 2,27 lần so vớ P. vivax (397/175). Riêng tại 28 tỉnh miền Bắc từ nhiều năm qua số ca P. vivax luôn chiếm ưu thế và năm 2010 có tổng số 870 ca có KSTSR dương tính thì tỷ lệ P. falciparum và P. vivax tương đương nhau (372/387) [11],[12]. Đây là vấn đề khó khăn về mặt kỹ thuật và trở ngại cho tiến trình tiến tới loại trừ sốt rét nói chung và cho P. vivax nói riêng bởi lẽ điểm đặc biệt trong chu kỳ sinh học và phát triển của loài P. vivax có tồn tại thể ngủ có thể tái phát xa sau vài tháng đên vài vài năm kể từ lần nhiễm đầu tiên, mặc dù bệnh nhân không vào vùng sốt rét nữa. Sau khi điều trị thuốc diệt thể vô tính và thuốc diệt thể ẩn và giao bào của P. vivax 3 ngày đầu bệnh nhân nội trú tại cơ sở y tế đầy đủ, song khi cấp thêm 11 ngày thuốc để đủ liệu trình phác đồ primaquin kéo dài 14 ngày cho bệnh nhân thì hầu như bệnh nhân không tuân thủ điều trị vì nhiều lý do khác nhau (do bệnh nhân cảm thấy hết sốt khoẻ lại, nên không uống nữa, hoặc có uống được vài ngày sau đó quên không uống thuốc, hoặc nhận thuốc được cấp nhưng sau đó về nhà cất hay cất trên nhà rẫy, không uống một viên nào), nên dễ dẫn đến thất bại trong diệt thể ngủ/ thể ẩn trong tế bào gan, dẫn đến tái phát xa liên tục và khó loại trừ nhiễm trùng P. vivax mạn tính trong lộ trình loại trừ sốt rét chung trên toàn cầu và Việt Nam. 
Hình 6
Trong khi chờ đợi một thuốc sốt rét mới thuộc nhóm 8-aminoquinolein liều duy nhất như tafenoquin có hiệu lực cao và lâu dài thay thế, thì đến nay liệu pháp primaquin 14 ngày được Bộ Y tế và TCYTTG khuyến cáo là cần thiết, nếu không quan tâm đến quản lý ca bệnh toàn diện kể cả khi ở cơ sở y tế và cả ở nhà thì có thể làm chậm tiến trình, nhất là hiện nay có sự đảo nghịch cơ cấu Trong cơ cấu ký sinh trùng sốt rét tại miền Trung-Tây Nguyên, ngoài hai loài phổ biến P. falciparum và P. vivax, một số tỉnh còn xuất hiện các loài hiếm gặp hơn như P. malariae (ở Đăk Lăk, Ninh Thuận, Khánh Hòa, Bình Thuận) và P. ovale (Bình Thuận), hay gần đây còn có loài ký sinh trùng từ động vật linh trưởng (nhất là khỉ giống Macaque) truyền sang người P. knowlesi (xác định ở Quảng Trị, Ninh Thuận, Khánh Hòa) chiếm tỷ lệ thấp hơn 1%, hay nhiễm phối hợp các loài Plasmodium spp. cũng hay gặp ở các vùng lưu hành nặng, nên có thể trong thời gian đến cơ cấu có thể thay đổi tiếp tục như đã từng xảy ra tại một số bang của Đông Timor và Malaysia gần đây công bố. So sánh với một vài dữ liệu trên thế giới, số liệu của TCYTTG cho biết ức tính 2,85 tỷ người có nguy cơ nhiễm P. vivax (WHO, 2010), đặc biệt tại Đông Nam Á, Trung và Nam Mỹ. Trong một thập niên qua, tại nhiều vùng sốt rét nặng có cơ cấu KST đảo ngược, thậm chí cân bằng giữa P. falciparum và P. vivax. Nếu như trước năm 2010, tại hầu hết các vùng sốt rét lưu hành trên thế giới đều có tỷ lệ loài P. falciparum cao hơn so với loài P. vivax, nhất là các vùng trọng điểm sốt rét (ngoại trừ Triều Tiên, Hàn Quốc, Indonesia, Đông Timor, Papua New Guinea và một số nước Nam Mỹ luôn có số P. falciparum thấp hơn hoặc gần bằng với P. vivax). Trong thời gian 3 năm trở lại đây (2013-2015), số ca nhiễm P. vivax đơn thuần có xu hướng chuyển dịch cao gần bằng hoặc ngang P. falciparum như ở Thái Lan, Bhutan, Myanmar. Tuy nhiên, các quốc gia từ lâu có số ca P. vivax chiếm cao trong cơ cấu chưa có sự thay đổi đáng kể như Triều Tiên, Indonesia, Đông Timor, Bangladesh, Ấn Độ (WHO, 2015). P. vivax đặt ra một thách thức quan trọng để đạt đích thành công trong chiến lược loại trừ sốt rét trong những năm đến. Năm 2013, ước tính có 16 triệu ca trên toàn cầu, trong đó trên 50% số ca ngoài khu vực châu Phi. Không chỉ P. vivax tạo ra rào cản cho loại trừ mà nó ngày càng được nhận ra vai trò của nó mạnh hơn cả P. falciparum, đồng thời có thể dẫn đến sốt rét ác tính và tử vong. Nguyên tắc phòng chống sốt rét P. vivax cũng như đối với P. falciparum, nhưng chương trình đang đối mặt với thách thức. Tại nhiều vùng mà P. vivax xảy ra phổ biến, muỗi thường đốt vào đầu buổi tối, ăn máu ngoài nhà và cả trong nhà. Do vậy, các màng tẩm hóa chất và phun tồn lưu trong nhà tỏ ra ít hiệu quả để giảm lan truyền P. vivax. Nhiễm trùng P. vivax giai đoạn hồng cầu xảy ra cả khi mật độ ký sinh trùng thấp và có thể bỏ sót khi soi kính hiển vi hoặc sử dụng test nhanh chẩn đoán. Ngoài ra, giai bào thường sinh ra và ký sinh trùng sẽ truyền sang muỗi trước khi có triệu chứng. Chỉ có lựa chọn duy nhất điều trị thể ngủ trong gan là thuốc primaquin nhưng thường bệnh nhân không tuân thủ 14 ngày, hơn nữa thuốc này lại bị chống chỉ định trên các phụ nữ mang thai, người thiếu men glucose-6-phosphate dehydrogenase (G6PD) và trẻ em dưới 6 tháng tuổi nên vì thế một tỷ lệ nhỏ bệnh nhân vẫn còn thể ngủ trong gan. Giờ đây, các nhà khoa học đang nghiên cứu tiếp tục phát triển các công cụ mới gồm cả thuốc để làm thế nào giảm lan truyền P. vivax, đặc biệt trên các nhóm cơ địa đặc biệt như trẻ em nhỏ và phụ nữ mang thai, tăng khả năng phát hiện và điều trị tiệt căn thì mới sớm đạt đích loại trừ sốt rét vào năm 2030. 
Hình 7
Vì tác động, khó khăn và rào cản cũng như phạm vi phân bố sốt rét do P. vivax rộng khắp toàn cầu và chúng chịu đựng một phạm vi thay đổi trong điều kiện môi trường biến đổi so với 4 loài Plasmodium spp. còn lại như thế (WHO, 2015), nên các biện pháp đang can thiệp hiện nay vào cả hai loài này là cần thiết, nhất là các vùng đang song hành P. vivax và P. falciparum. Ngoài ra, các biện pháp phòng chống cổ điển như phun tồn lưu và sử dụng màn tẩm nhằm hạn chế phơi nhiễm giữa con người với muỗi là tối thiểu, ít có hiệu quả đối với P. vivax so với P. falciparum bởi vì tại nhiều vùng có P. vivax chiếm ưu thế, muỗi đốt vào đầu buổi tốt để hút máu ngoài nhà và sau đó đậu ngoài nhà. Hơn nữa, phòng chống vector không có tác động trên ổ chứa là giai đoạn thể ngủ trong tế bào gan ở người nên góp phần một tỷ lệ mắc bệnh rất cao cho cộng đồng [42],[68]. Sốt rét do P. vivax thường khó phát hiện và điều trị tận gốc do mật độ ký sinh trùng trong máu thường thấp so với P. falciparum và các xét nghiệm hiện nay khong thể phát hiện thể ngủ trong gan nên một lượng ổ chứa ký sinh trùng trong cơ thể người không được biết đến. Điều trị thể ngủ và giao bào đồng thời của P. vivax cần đến liệu trình 14 ngày primaquin phosphate song có một số nhược điểm trong chống chỉ định như phụ nữ mang thai, trẻ em nhỏ dưới 6 tháng, thiếu máu và thiếu men G6PD, nên nhiều thầy thuốc lâm sàng không thể quyết định khi cân nhắc lợi ích - nguy cơ trong điều kiện không sẵn có test chẩn đoán G6PDH, nếu không điều trị, có thể dẫn đến tăng gánh nặng bệnh tật do P. vivax [17],[18]. Phòng chống và loại trừ sốt rét P. vivax thành công có thể phải cần đến các biện pháp bổ sung đặc biệt: (i) Tiếp cận kiểm soát muỗi đốt máu và đậu ngoài nhà ở những nơi có lan truyền bệnh; (ii) Đảm bảo dịch vụ chẩn đoán kính hiển vi luôn sẵn có và có thể phát hiện nhiễm trùng P. vivax ở mật độ thấp hay test chẩn đoán nhanh có thể phát hiện đồng thời hai loại kháng nguyên đích P. falciparum vàP. vivax; (iii) Có thể triển khai kiểm tra xét nghiệm thiếu men G6PD trước khi cho liệu pháp primaquin dài ngày như hiện nay [23],[24]. 
Hình 8
Theo báo cáo của TCYTTG số quốc gia có ca P. vivax giảm từ 58 nước vào năm 2000 thì đến năm 2013 chỉ còn 49 nước. Về phân bố địa lý rộng và tỷ lệ mắc mới của sốt rét do P. vivax và khoảng 35% dân số toàn cầu có nguy cơ nhiễm. Sự phân bố P. vivax bị chi phối bởi diện phân bố của vector phù hợp trong hơn 70 loài muỗi Anopheles spp. có thể truyền sốt rét do P. vivax dù chỉ có 40 loài góp phần ý nghĩa trong lan truyền, thứ hai là điều kiện thời tiết cho phép ký sinh trùng phát triển trong cơ thể muỗi, nhất là nhiệt độ, thứ ba là đặc tính di truyền ở người, đặc biệt là các quần thể có nhóm máu Duffy (-) phổ biến như ở miền Trung Sudan, châu Phi nhưng hiếm ở các vùng còn lại [55]. Trên các cá nhân không có kháng nguyên Duffy, hồng cầu sẽ chống lại nhiễm trùng P. vivax theo cơ chế “bệnh chống bệnh”, đó cũng là lý do tại sao P. vivax hiếm ở nhiều vùng châu Phi [25]. Giải thích về thay đổi cơ cấu giữa hai loài hiện nây vẫn còn chưa thấu đáo, song một số bằng chứng cho thấy có thể giúp lý giải phần nào: (i) Trong gần 20 năm (2007-2017), hầu hết các đầu tư kinh phí vào phòng chống và loại trừ sốt rét tập trung đánh mạnh vào các khung hành động của Tổ chức Y tế thế giới nhằm làm giảm lan truyền bệnh, trong đó có cả P. falciparum và P. vivax; (ii) Chiến lược toàn cầu ngăn chặn sốt rét kháng artemisinin đã khởi động và đầu tư từ năm 2010 chủ yếu đến nghiên cứu và hỗ trợ kỹ thuật về làm thế nào điều trị tiệt căn loài P. falciparum kháng thuốc, kể cả điều trị có theo dõi trực tiếp (DOT-Directly Observed Treatment) nên số ca P. falciparum đã giảm đi nhanh chóng so với P. vivax; (iii) Trong điều trị sốt rét do P. falciparum hiện nay tại hầu hết các quốc gia có sốt rét lưu hành chủ yếu dựa vào phác đồ thuốc phối hợp ưu tiên có thành phần artemisinin (Artemisinin based combination therapies-ACTs), trong đó hoạt chất artemisinin hay dẫn chất dihydroatemisinin có tác dụng diệt nhanh dung khối ký sinh trùng thể vô tính và giao bào non ngay ban đầu, nên sẽ gián tiếp ức chế hình thành thể phân liệt và giao bào từ thể vô tính, giảm nhanh số giao bào, từ đó giảm lan truyền bệnh và số ca P. falciparum cũng giảm theo, trong khi đó thuốc chloroquin diệt thể vô tính P. vivax thì không ức chế chuyển dạng từ thể vo tính sang phân liệt và cũng không giết chết giao bào non nên vì thế số ca P. vivax có thể chưa thay đổi nhiều. Sự chuyển dịch cơ cấu ký sinh trùng như thế sẽ tác động không nhỏ lên bức tranh sốt rét của quốc gia, tình hình ký sinh trùng Plasmodium spp. nhạy-kháng thuốc khác nhau, khó khăn trong quản lý ca bệnh, các nhà làm chính sách thuốc phải cân nhắc và dự toán kinh phí mua các thuốc sẽ thay đổi, đặc biệt thuốc primaquin phosphat số lượng lớn hơn.
TÀI LIỆU THAM KHẢO
Tài liệu tiếng Việt 1.Bộ Y tế (2016). Hướng dẫn chẩn đoán và điều trị bệnh sốt rét. Quyết định số 4845/QĐ-BYT, ngày 08 tháng 9 năm 2016. 2.Nguyễn Thị Liên Hạnh, Huỳnh Hồng Quang, Nguyễn Doãn Khôi, Nguyễn Đức Hồng và cs., (2016). Nghiên cứu đột biến gen K13 và tình trạng chậm làm sạch ký sinh trùng Plasmodium falciparum tại Đăk Nông và Gia Lai. Báo cáo khoa học toàn văn. Hội nghị Ký sinh trùng học toàn quốc lần thứ 43, Buôn Ma Thuột, Đăk Lăk, 01.04.2016. NXB Khoa học Tự nhiên và Công nghệ. ISBN:978-604-913-442-5, trang 87-93. 3.Huỳnh Hồng Quang, Nguyễn Tấn Thoa, Cao Văn Ảnh và cs., (2009). Đánh gía hiệu lực tái nhạy và hiệu lực tích lũy phác đồ chloroquin trên bệnh nhân sốt rét chưa biến chứng do P. falciparum và P. vivax tại vùng SRLH miền Trung-Tây Nguyên, 2005-2007. Tạp chí Y dược học quân sự, ISSN 1859-1655, tr.12-19. 4.Huỳnh Hồng Quang, Hồ Văn Hoàng, Nguyễn Phú Cường (2011). Nhân một trường hợp sốt rét ác tính do P.vivax tại Đăk Lăk: Tổng hợp thông tin và cập nhật y văn thế giới. Tạp chí Y học thực hành, ISSN 1859-1663, trang 193-199. 5.Huỳnh Hồng Quang, Triệu Nguyên Trung, Hồ Văn Hoàng và cs., (2012). So sánh hiệu lực phác đồ thuốc dihydroartemisinin-piperaquin với choroquin trong điều trị sốt rét do Plasmodium vivax, 2011. Y học TP. Hồ Chí Minh, tập 16, phụ bản số 3, chuyên đề Y tế công cộng, tr. 199-205. 6.Huỳnh Hồng Quang, Triệu Nguyên Trung, Nguyễn Văn Chương và cs., (2013). Sốt rét ác tính do P. vivax: Báo cáo ca bệnh tại Bình Định và tổng hợp y văn thế giới. Y học TP.Hồ Chí Minh, tập 17, phụ bản số 1, 2013; 50-56. 7.Huỳnh Hồng Quang, Triệu Nguyên Trung, Nguyễn Văn Chương, Nguyễn Tấn Thoa (2013). Đáp ứng của ký sinh trùng sốt rét P. vivax với phác đồ chloroquin tại ba tỉnh miền Trung-Tây Nguyên, 2012. Y học TP. Hồ Chí Minh, tập 17, phụ bản số 1, 2013; 74-79. 8.Huỳnh Hồng Quang, Nguyễn Đức Hồng,Lý Chanh Ty và cs., (2017). Đánh giá hiệu lực phác đồ chloroquin trong điều trị bệnh nhân sốt rét do Plasmodium vivax tại một số điểm miền Trung-Tây Nguyên (2014-2017). Tạp chí Phòng chống Sốt rét và các bệnh ký sinh trùng, Viện Sốt rét-KST-CT TƯ, Số chuyên đề Hội nghị Nghiên cứu sinh tháng 11/2017. 9.Viện Sốt rét-KST-CT Quy Nhơn (2011). Báo cáo tổng kết công tác Phòng chống sốt rét và giun sán 2006-2010 và triển khai kế hoạch năm 2011. 10.Viện Sốt rét-KST-CT Quy Nhơn (2017). Báo cáo tổng kết công tác Phòng chống sốt rét và giun sán 2011-2015 và triển khai kế hoạch năm 2016. 11.Viện Sốt rét-KST-CT Trung ương (2011). Báo cáo tổng kết công tác Phòng chống sốt rét và giun sán 2006-2010 và triển khai kế hoạch năm 2011. 12.Viện Sốt rét-KST-CT Trung ương (2017). Báo cáo tổng kết công tác Phòng chống sốt rét và giun sán 2006-2015 và triển khai kế hoạch năm 2016. Tài liệu tiếng nước ngoài 13.André M Siqueira, Lucas I Coutinho, Rafael L Gurgel, Willian CS Su (2014). Slow clearance of Plasmodium vivax with chloroquin amongst children younger than six months of age in the Brazilian Amazon. Mem Inst Oswaldo Cruz, Rio de Janeiro, Vol. 109 (5): 540-545. 14.Anam A Waheed, Najia K Ghanchi et al., (2015). Vivax malaria and chloroquin resistance: A neglected disease as an emerging threat. Malaria Journal, 2015 14:146 15.Atul Goel, Ankit Mangla and Tejinder Singh et al., (2014). Changing pattern of vivax malaria. Pediat Therapeut 4: e124. doi: 10.4172/2161-0665.1000e1 16.Baird JK, Caneta-Miguel E et al., (2003). Survey of resistance to chloroquin of falciparum and vivax malaria in Palawan, Philippines. Ann Pharmacother, 2003; 37(4):526-9. 17.Baird J. Kevin, Neena Valecha, Stephan Duparc et al., (2016). Diagnosis and treatment of vivax malaria diagnosis and treatment of Plasmodium vivax malaria. The American Society of Tropical Medicine and Hygiene, vol.5, 2016; doi:10.4269/ajtmh.16-0171. 18.Baird J. Kevin et al., (2016). Attacking Plasmodium vivax. The American Society of Tropical Medicine and Hygiene, published online October 5, 2016; doi:10.4269/ajtmh.16-0517. 19.BS Bal, Ashok Duggal, Sachin Khurana, Jasleen Kaur (2012). Haematological abnormalities in Plasmodium vivax malaria. JIACM 2012; 13(3):236-8. 20.Barnardas C, Ratsimbasoa A, Tichit M et al., (2008). Plasmodium vivax resistance to chloroquin in Madagasca: Clinical efficacy and polymorphisms in pvmdr1 and pvcrt-o genes. Antimicrob Agents Chemother; 52(12):4233-40. 21.Bruno B A, Antonio R F, Sebastiao et al., (2010). Severe Plasmodium vivax malaria exhibits marked inflamatory imbalance. Malaria Journal 2010, 9:13. 22.Yan Bi, Weiwei Yu, Wenbiao Hu, Hualiang Lin (2013). Impact of climate variability on Plasmodium vivax and Plasmodium falciparum malaria in Yunnan province, China. Parasites and vectors 2013, 6:357 23.Chen N, Auliff A, Rieckmann K, Gatton M, Cheng Q et al., (2007). Relapse of Plasmodium vivax infection result from clonal hypnozoites activated at predeterminated intervals. Journal of infectious diseases, 195:934-941. 24.Clarissa M. Moreira, Mahmoud Aboshehada, Ric N. Price (2015). A systematic review of submicroscopic Plasmodium vivax infection. Malar J (2015) 14:360. 25.Dhanpat K. Kochar, Vishal Saxena, Narvachan Singh et al., (2005). Plasmodium vivax malaria. Emerging Infectious Diseases, vol.11, No.1. 26.Nicholas M Douglas, Nicholas M Anstey, Pierre A Buffet (2012). The anaemia of Plasmodium vivax malaria. Malaria Journal, 2012, :135 27.ECDC (2012). Rapid risk assessment autochthonous Plasmodium vivax malaria in Greece. European Centre for Disease Prevention andControl, Stockholm. 28.Fabio T.M. Costa, Stefanie C.P. Lopes, Letusa Albrecht (2012). On the pathogenesis of Plasmodium vivax malaria: Perspectives from the Brazilian field. J. Parasitol. (2012), doi.org/10.1016/j.ijpara.2012.08.007 29.Fontoura PS, Finco BF, Lima NF, de Carvalho JF et al., (2016). Reactive case detection for Plasmodium vivax malaria elimination in rural Amazonia. PloS Negl Trop Dis 10(12): e0005221. doi:10.1371 30.Fryauff DJ, Tuti S, Mardi A et al., (2004). Chloroquin resistant Plasmodium vivax in transmigration settlement of west Kalimantan, Indonesia. Am J Trop Med Hyg; 59 (4):513-8. 31.Gething PW, Elyazar IRF, Moyes CL et al., (2012). A neglected world malaria map: Plasmodium vivax endemicity in 2010. PloS Negl Trop Dis 6(9):e1814. 32.Giao PT, Binh TQ, Peter VJ, Hung LQ, Nam NV et al., (2002). Artemisinin or chloroquin for blood stage Plasmodium vivax malaria in Vietnam. Tropical Medicine and International health, 2002, 7:856-864 33.Gogtay NJ, Desai S, Kadam VS et al., (2000). Relapse pattern of Plasmodium vivax in Mumbai: A study of 283 cases of vivax malaria. J. Assoc Physicician India; 48(11):1085-6. 34.Goller JL, Jolley D, Ringwald P, Biggs BA (2007). Regional differences in the response of Plasmodium vivax malaria to primaquin as anti-relapse therapy. American Journal of Tropical medicine and Hygiene, 76:203-207. 35.Ghulam Rahim Awab, S. Pukrittayakamee et al., (2010). Dihydroartemisinin-piperaquin versus chloroquin to treat vivax malaria in Afghanistan: An open randomized, non-inferiority, trial. Malaria Journal 9:105. 36.Guthmann JP, Pittet A, Lesage A, Imwong M, Nosten F et al., (2008). Plasmodium vivax resistance to chloroquin in Dawei, Southern Myanmar. Trop Med Int Health. 2008;13(1):91-8. 37.Hai-Mo Shen, Shen-Bo Chen, Yue Wang, Jun-Hu Chen (2015). Whole genome sequencing of a Plasmodium vivax isolate from the China-Myanmar border area. Mem Inst Oswaldo Cruz, Rio de Janeiro, Vol. 110(6): 814-816. 38.Hampate B., Craig W. Duffy, Ambroise D. Ahouidi (2016). Widespread distribution of Plasmodium vivax malaria in Mauritania on the interfaceof the Maghreb and West Africa. Malar Journal 2016;15:80 39.Imwong M, Snounou G, Nurhayati et al. (2007). Plasmodium vivax infection usually result from activation of heterologous hypnozoites. Journal of Infectious Diseases, 195:927-933. 40.Jean Popovici, Didier Ménard et al., (2015). Challenges in antimalarial drug treatment for vivax malaria control. Trends in Molecular Medicine, 2015, Vol. 21, No.12: 1-13 41.Katherine E Battle, Markku S Karhunen et al., (2014). Geographical variation in Plasmodium vivax relapse. Malaria Journal 2014, 13:144. 42.Katherine E. Battle, Carlos A. Guerra, Nick Golding et al., (2015). Global database of matched Plasmodium falciparum and P. vivax incidence and prevalence records from 1985-2013. www.nature.com/data/ 2:150012. 43.Kanchana Rungsihirunrat, Poonuch Muhamad, Wanna Chaijaroenkul et al., (2015). Plasmodium vivax drug resistance genes; Pvmdr1 and Pvcrt-o Polymorphisms in relation to chloroquin sensitivity from a malaria endemic area of Thailand. Korean J Parasitol Vol. 53, No.1: 43-49. 44.Ketema Tsige, Ketema Bacha, Tarekegn Birhanu et al., (2009). Chloroquin-resistant Plasmodium vivax malaria in Serbo town, Jimma zone, south-west Ethiopia. Malaria journal; 8:177. 45.Khojasteh Sharifi-Sarasiabi, Ali Haghighi, Bahram Kazemi et al., (2016). Molecular surveillance of P. vivax and P. falciparum dhfr mutations in isolates from southern Iran. Rev. Inst. Med. Trop. Sao Paulo, 2016;58:16 46.Kitchener S, Nasveld P, Edstein MD et al., (2007). Tafenoquin for the treatment of recurrent P. vivax malaria. Am J Trop Med Hyg, 2007:76 (3):494-6 47.Kurcer MA, Simek Z, Kurcer Z et al., (2006). The decreasing efficacy of chloroquin in the treatment of P.vivax malaria, in Sanliurfa, south-eastern Turkey. Ann Trop Med Parasitol, 2006;100(2):109-13. 48.Latif I, Jamal A et al., (2015). Hematological changes in complete blood picture in paedriatric patients of malaria caused by P. vivax and P. falciparum. J Ayub Med Coll Abbottabad. 2015;27(2):351-5. 49.Lee KS, Kim TH, Kim ES et al., (2009). Short report: chloroquin resistant P. vivax malaria in the Republic of Korea. Am J Trop Hyg, 80(2):215-7. 50.Leeha Singh, Surbhi Rathi, Santosh Kondekar et al., (2016). Per protocol analysis of therapeutic efficacy of chloroquin for the treatment of Plasmodium vivax malaria in children. International journal contemporary paediatrics. http://dx.doi.org/10.18203/2349-3291.ijcp20161909 51.Lígia Antunes Gonçalves, Pedro Cravo, Marcelo Urbano Ferreira (2014). Emerging Plasmodium vivax resistance to chloroquin in South America: An overview. Mem Inst Oswaldo Cruz, Rio de Janeiro, Vol.109 (5): 534-539. 52.Lili Yuan, Ying Wang, Daniel M. Parker et al., (2015). Therapeutic responses of P.vivax malaria to chloroquinand primaquin treatment in Northeastern Myanmar. Antimicrob Agents Chemother 59:1230-1235. 53.Lemu Golassa, Berhanu Erko, Frederick N Baliraine, Abraham Aseffa (2015). Polymorphisms in chloroquin resistance-associated genes in Plasmodium vivax in Ethiopia. Malaria Journal (2015) 14:164. 54.Luciano Rodrigues Simões, Eduardo Rodrigues Alves-Jr et al., (2010). Factors associated with recurrent Plasmodium vivax malaria in Porto Velho, Rondonia State, Brazil, 2009. Cad. Saúde Pública, Rio de Janeiro, 30(7):1403-1417. 55.Mohamed H. Abdelraheem, Musab M. A. Albsheer et al., (2016). Transmission of Plasmodium vivax in Duffy-negative individuals in central Sudan. Trans R Soc Trop Med Hyg; 110:258-260. 56.Mueller I, Galinski MR, Baird JK et al. (2009). Key gaps in the knowledge of P. vivax, a neglected human parasite. Lancet Infect Dis; 9(9): 555-66. 57.Nacher M, Silachamroon U et al., (2004). Risk factors for Plasmodium vivax gametocyte carriage in Thailand. Am J Trop Med, 2004;71(6):693-5. 58.Nandy A, Addy M, Maji AK et al., (2003). Monitoring the chloroquin sensitivity of P. vivax from Calcutta and Orissa, India. Ann Trop Parasitol; 97 (3):215-20. 59.Orjuela-Sanchez P, Da Silva NS, da Silva-Nune M et al., (2009). Recurrent parasitemia and population dynamics of Plasmodium vivax polymorphisms in rural Amazonia. Am J Trop Med and Hyg; 81(6):961-8. 60.Park JW, Jun G, Yeom JS et al., (2009).Plasmodium vivax malaria: Status in the Republic of Korea following reemergence. Korean J Parasitol; 47 Suppl:S39-50. 61.Price RN, Tjitra E, Guerra CA et al., (2007). Vivax malaria: Negleted and not benign. Am J Trop Med Hyg; 77(6 suppl):79-87. 62.Price RN, Douglas NM, Anstey NM et al., (2009). New developments in Plasmodium vivax malaria: severe disease and the rise of chloroquin resistance. Curr Opin Infect Dis; 22(5); 430-5. 63.Purva Gupta, Rajni Sharma, Jagdish Chandra, Vineeta Singh (2016). Severe malaria due to Plasmodium vivax: Case report. Curr pediatr res; 20:24-28. 64.Ric N Price, Lorenz von Seidlein, Neena Valecha et al., (2014). Global extent of chloroquin-resistant Plasmodium vivax: A systematic review and meta-analysis. Lancet Infect Dis2014;14:982-91. 65.Rosalind E. Howes, Katherine E. Battle, Kamini N. Mendis et al., (2016). Global Epidemiology of Plasmodium vivax. Am. J. Trop. Med. Hyg., 95(Suppl 6), 2016:15-34. 66.Roy M, Bouma MJ, Ionides EL, Dhiman RC et al., (2016). The Potential elimination ofPlasmodium vivax malaria by relapse treatment: Insights from atransmission model and surveillance data from Northwest, India. PLoS Negl Trop Dis 7(1): e1979. 67.Ruth O. Payne, Paul M. Griffin, James S. McCarthy et al., (2017). Plasmodium vivax controlled human malaria infection: Progress and prospects. Trends in Parasitology, February 2017, Vol.33, No. 2. 68.Smith David L, Cibulskis Richard E, Battle Katherine E et al., (2016). Global Epidemiology of Plasmodium vivax. WHO/IRIS-http://apps.who.int/iris/ 69.Soto J, Toledo J, Gutierrez P et al., (2001). Plasmodium vivax clinically resistant to chloroquin in Colombia. Am J Trop Hyg Aug; 65(2):90-3. 70.Stano I, Suprijanto S, Nurhayati et al., (2009). Resistance to chloroquin by Plasmodium vivax at Alor in the Lessser Sundas archipelago in eastern Indonesia. Am J Trop Med Hyg, 2009 Aug;81(2):338-42. 71.Hiwot Teka, Beyene Petros, Lawrence Yamuah et al., (2008). Chloroquin-resistant Plasmodium vivax malaria in Debre Zeit, Ethiopia. Malaria journal, 2008 Oct 29; 7-220. 72.Pham Vinh Thanh, Hong Nguyen Van, Melva Louisa et al., (2015). Confirmed Plasmodium vivax resistance to chloroquin in Central Vietnam. Antimicrob. Agents Chemother.doi:10.1128/AAC.00791-15. 73.Tjitra E, Anstey NM, Sugiarto P et al. (2008). Multidrug-resistant Plasmodium vivax associated with severe and fetal malaria: A prospective study in Papua, Indonesia. Pls Med, 2008 Jun 17; 5(6):128. 74.Toi Van Pham, Phuong Pham Nguyen, Thomas Pouplin et al., (2016). An HPLC method with diode array detector for the simultaneous quantification of chloroquin and desethylchloroquin in plasma and whole blood samples from Plasmodium vivax patients in Vietnam, using quinine as an internal standard. Biomed. Chromatogr. 2016; 30: 1104-1111 75.Vijaykadga S, Rojanawatsivej C, Congpoung K et al., (2004). Assessment of therapeutic efficacy for vivax in Thailand. Southeast Asian J Trop Med public Health, 2004; 35(3):566-9. 76.Vinod P. Sharma, Vas Dev, Sobhan Phookan et al., (2015). Neglected Plasmodium vivax malaria in northeastern States of India. Indian J med Res 141:546-555 77.WHO (2009). Methods for surveillance of antimalarial drug efficacy. 78.WHO (2009). Parasitological confirmation of malaria diagnosis. 79.WHO (2012). ICH - GCP Guidelines for Clinical Trials 80.WHO (2015). Control and Elimination of Plasmodium vivax malaria. 81.WHO (2015). Confronting of Plasmodium vivax malaria. 82.WHO (2016). World malaria report. http://www.who.int/malaria/publications/world-malaria-report-2016/report/en/ 83.Yehenew A Ebstie1, Solomon M Abay et al., (2016). Tafenoquin and its potential in the treatment and relapse prevention of vivax malaria: The evidence to date. Drug design, development and therapy. Open Access, dx.doi.org/ 84.Yeom JS, Jun G, Kim JY, Lee WJ, Shin EH et al., (2012). Status of Plasmodium vivax malaria in the Republic of Korea, 2008-2009: Decrease followed by resurgence. Trans R Soc Trop Med Hyg.;106(7):429-36.
|

