|
Coartem (Artemether/ Lumefantrine)-Thuốc chống sốt rét có tiềm năng trong bối cảnh kháng thuốc sốt rét lan rộng ?
Coartem là tên biệt dược của một thuốc phối hợp thành phần trong một viên thuốc gồm artemether và lumefantrine. Artemether và lumefantrine vốn dĩ là các thuốc chống sốt rét đã từng gây cản trở cho sự phát triển của ký sinh trùng vào trong hồng cầu và cơ thể người và được nghiên cứu thử nghiệm và sử dụng rộng rãi tại một số quốc gia châu Phi, Nam Mỹ và Đông Nam Á. Theo tiến trình phát triển các dòng sản phẩm thuốc mới trong thời gian gần đây và thời gian đến, Coartem là loại thuốc chỉ để điều trị chứ không dùng dự phòng và chỉ định trong các ca sốt rét thường, không có biến chứng hay sốt rét ác tính (SRAT) và đây là thuốc có vị trí quan trọng trong cuộc chiến chống lại ký sinh trùng P. falciparum đa kháng thuốc tại nhiều quốc gia. Viên thuốc Coartem chứa một phối hợp gồm hai thành phần có hoạt tính chống sốt rét là dẫn suất artemisinin loại artemether và lumefantrine. Cả hai thành đều có tác đụngiệt thể vô tính trong máu (blood schizontocides). Tên hóa chất của artemether là (3R,5aS,6R,8aS,9R,10S,12R,12aR)-10-methoxy-3,6,9-trimethyldecahydro-3,12-epoxypyrano[4,3-j]-1,2benzodioxepine. Artemether là một chất màu trắng, bột tinh thể và có thể hòa tan tự do trong acetone, hòa tan trong methanol và ethanol, không thể hòa tan trong nước. Nó có công thức thể hiện các tỷ lệ các nguyên tố trong hợp chất là C16H26O5 với một trọng lượng phân tử là 298.4 và công thức cấu trúc như dưới đây.
. 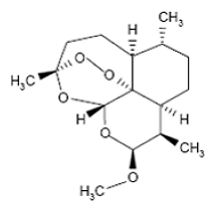 | 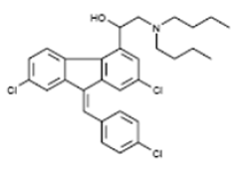 | Công thức cấu trúc Artemether | Công thức cấu trúc Lumefantrin |
Tên hóa chất lumefantrine là (1RS)-2-(dibutylamino)-1-{(9Z)-2,7-dichloro-9-[(4chlorophenyl)methylene]-9H-fluorene-4-yl}ethanol. Lumefantrine là một chất bột tinh thể màu vàng, tan tự do trong N,N-dimethylformamide, chloroform và ethyl acetate; có thể hòa tan trong dichloromethane, tan nhẹ trong ethanol và methanol và không hòa tan trong nước. Nó có công thức phân tử là C30H32Cl3NO với trọng lượng phân tử 528.9 và cấu trúc như hình trên. Viên thuốc Coartem được chỉ định bằng đường uống, mỗi viên chứa 20 mg artemether và 120 mg lumefantrine. Các thành phần phụ gia đi kèm gồm silicon dioxide dạng nhũ dịch, croscarmellose sodium, hypromellose, magnesium stearate, microcrystalline cellulose và polysorbate 80. Tương tác thuốc trong quá trình điều trị-Trước hết bệnh nhân cần thông tin cho bác sĩ điều trị biết bạn đang dùng loại thuốc nào bất kỳ để điều trị bệnh khác hay không? -Một số thuốc có thể tương tác với Coartem và vì thế không nên sử dụng đồng thời, đặc biệt với các thuốc như dexamethasone, nefazodone, rifampin; -Cần thận trọng khi dùng chung với phác đồ một số kháng sinh hoặc thuốc chống nấm như clarithromycin, erythromycin, itraconazole, ketoconazole, posaconazole, rifampin, telithromycin, voriconazole; -Thuốc điều trị viêm gan siêu vi C như boceprevir, telaprevir; thuốc điều trị HIV/AIDS loại atazanavir, cobicistat, darunavir, delavirdine, fosamprenavir, indinavir, nelfinavir, ritonavir, saquinavir; -Thuốc chống động kinh: carbamazepine, fosphenytoin, phenobarbital, phenytoin. Thận trọng khi dùng thuốc này -Bệnh nhân không nên dùng thuốc này nếu có tiền sử dị ứng với thành phần thuốc artemether hay lumefantrine; -Một số thuốc có thể tương tác có hại với artemether và lumefantrine thì không nên dùng tự ý và cần tham vấn ý kiến bác sĩ có thể cần đổi thuốc; -Để đảm bảo cho việc dùng thuốc Coartem cho bệnh nhân, thì bệnh nhân cần cho bác sĩ biết về tiền sử mắc bệnh tim mạch hiện tại hoặc gần đây, cá nhân các rối loạn nhịp hoặc tiền sử trong gia đình có hội chứng QT kéo dài trên hình ảnh điện tâm đồ, bệnh lý về gan, thận; -Bệnh nhân có hàm lượng kali hoặc magne trong máu thấp; -FDA cảnh báo và phân loại các biến cố bất lợi thuốc Coartem trong nhóm “pregnancy category C”, không biết thuốc Coartem sẽ gây hại cho thai nhi hay không, nên cần thông báo cho bác nếu bệnh nhân có thai trong khi dùng thuốc này; Thuốc Coartem (Artemether/lumefantrine) trên phụ nữ mang thai-Artemether-lumefantrine đã được ấn định theo phân loại category C đối với phụ nữ mang thai bởi cơ quan FDA. Các nghiên cứu trên động vật cho thấy bằng chứng làm ảnh hưởng hoặc tác động trên phôi thai và khuyết tật hoặc chết (embryo-fetal loss and fetal defects); -Các dữ liệu an toàn từ các nghiên cứu quan sát trên 500 phụ nữ đang mang thai có phơi nhiễm với thuốc artemether-lumefantrine (gồm có 1/3 số đó phơi nhiễm trong 3 tháng đầu thai kỳ) và các dữ liệu đã được ấn bản với trên 1.000 phụ nữ mang thai đã từng phơi nhiễm dẫn suất artemisinin, kết quả cho thấy không gia tăng các tác dụng ngoại ý trong quá trình mang thai hoặc sinh quái thai so với dữ liệu nền ban đầu trước đó. Artemether-lumefantrine chỉ được khuyến cáo dùng cho phụ nữ mang thai nếu lợi ích lớn hơn nguy cơ; -Một nghiên cứu quan sát gần đây, do nhóm tác giả Christine Manyando và cộng sự (2015) cho thấy nhóm phụ nữ mang thai trong ba tháng đầu dùng thuốc/ hay đúng ra là phơi nhiễm với thuốc qua một nghiên cứu quan sát tại Zambia cho thấy phần lớn các dữ liệu về an toàn của nhóm thuốc ACTs nói chung trên phụ nữ mang thai vẫn còn hạn chế. Do đó, các phụ nữ mang thai đến từ Choma, Zambia đã phơi nhiễm với thuốc artemether-lumefantrine trong điều trị sốt rét chưa biến chứng được theo dõi và đánh gá theo nghiên cứu thuần tập tiến cứu. Báo cáo đánh giá các dữ liệu an toàn trong nghiên cứu theo dõi dọc trên các phụ nữ mang thai tình cờ uống thuốc sốt rét trong 3 tháng đầu. Các đối tượng tham gia nghiên cứu được chia dựa trên loại thuốc sử dụng điều trị sốt rét gần đây gồm artemether-lumefantrine (AL) so với sulphadoxine-pyrimethamine (SP) và / hoặc quinine. Tất cả phụ nữ đưa vào theo dõi đến 6 tuần sau sinh và còn sống đến 12 tháng. Kết quả cho thấy có 294 phụ nữ mang thai trong 3 tháng đầu trong nghiên cứu thuần tập tiến cứu (phụ nữ mang thai dùng AL là 150; AL và SP là 9 và SP và/hoặc quinin là 135). Tương tự, tỷ lệ tử vong chu sinh thấy trên mỗi nhóm điều trị (AL là 4,4%, SP và/hoặc quinine là 3,9%). Vào thời điểm sinh (sơ sinh: AL là 135, AL và SP là 7 và SP và/ hoặc quinin là 129), tuổi thai (đo theo chỉ số Dubowitz) là tương tự nhau giữa các nhóm. Cân nặng trẻ sinh ra thấp được báo cáo lần lượt là 10,2% (95% CI 6.0, 16.6) và 6,7% (95% CI 3.4, 12.6) của các trẻ sơ sinh sinh ra trên nhóm dùng AL và SP và/ hoặc quinine. Phát triển tổng thể (gồm cả các thông số phát triển về thần kinh) tương tự giữa hai nhóm, ở cả 14 tuần và 12 tháng tuổi. Điều này cho thấy việc phơi nhiễm với AL và SP trong thời gian 3 tháng đầu không có liên quan gì đặc biệt đến nguy cơ an toàn của thuốc như tử vong chu sinh, sẩy thai, cân nặng thấp. Các kết quả như thể cũng như phát triển thần kinh ở trẻ đến 12 tháng tuổi đều tương đương giữa 2 nhóm. Các số liệu này bổ sung vào các thử nghiệm lâm sàng ngẫu nhiên tin cậy hơn. Thuốc Artemether/lumefantrine trên phụ nữ đang cho con bú-Không thấy dữ liệu về bài tiết thuốc artemether hoặc lumefantrine vào trong sữa mẹ. Tuy nhiên, các dữ liệu trên nghiên cứu động vật cho thấy cả thuốc artemether và lumefantrine đều được bài tiết vào trong sữa con mẹ. Các tác động trong việc chăm sóc trẻ không biết rõ ràng; -Nhà sản xuất khuyên rằng cần thận trọng sử dụng artemether-lumefantrine khi phụ nữ đó đang trong giai đoạn cho con bú; -Có thể sử dụng một biện pháp ngừa có thai như dùng bao cao su hoặc thuốc diệt tinh trùng. Thuốc ngừa thai dạng hormone uống, tiêm, cấy, miếng dán da và vòng tránh thai âm đạo không thể đủ hiệu quả ngừa thai trong quá trình điều trị chắc chắn; -Không biết thuốc artemether và lumefantrine có qua sữa mẹ hay không hoặc nếu có thì có gây hại cho trẻ em sin hra không. Do vậy, cần thông tin cho bác sĩ biết nếu đang nuôi con nhỏ mà cần dùng đến thuốc; -Coartem không nên dùng cho trẻ em có cân nặng < 5 kg. Dùng thuốc Coartem như thế nào đúng?-Uống thuốc Coartem chính xác như kê đơn của bác sĩ. Không được uống một lượng lớn hơn, nhỏ hơn hoặc kéo dài ngày hơn so với khuyến cáo; -Uống Coartem với thức ăn, sữa, bột yến mạch hay nước luộc thịt, bánh pudding. Thuốc có thể nghiền nát và trộn với 1-2 muỗng nước để dễ nuốt thuốc. Có thể ăn uống bình thường trong thời gian uống thuốc để có thể giúp thuốc hấp thu vào cơ thể tốt hơn; -Nếu bạn bị nôn trong vòng 1-2 giờ sau khi uống thuốc, có thể dùng lại liều khác. Nếu còn tieeos tục nôn mửa hoặc không thể ăn, có thể yêu cầu trợ giúp của bác sĩ; -Coartem thường được cho tổng cộng 6 liều trong thời gian 3 ngày. Cẩn thận theo hướng dẫn của bác sĩ về số liều thuốc và số viên thuốc uống trên từng bệnh nhân. Liều Coartem dựa trên cân nặng và nhóm tuổi. Liều thật sự cho tính toán như sau, trừ khi có yêu cầu khác của bác sĩ: Đối với người trên 16 tuổi và cân nặng ít nhất 35 kg: ·Uống 4 viên như một liều khởi đầu; ·Uống tiếp 4 viên nữa sau đó 8 giờ; ·Uống 4 viên vào buổi sáng và 4 viên vào buổi tốt trong 2 ngày tiếp theo. Đối với trẻ nhỏ hơn 16 tuổi cân nặng từ 25 - 35kg: ·Uống 3 viên như một liều khởi đầu; ·Uống thêm 3 viên nữa vào thời điểm 8 giờ sau liều thứ nhất; ·Uống 3 viên vào buổi sáng và 3 viên vào buổi tốt trong 2 ngày tiếp theo. Đối với trẻ em nhỏ hơn 16 tuổi và cân nặng từ 15 - 25 kg: ·Uống 2 viên như một liều khởi đầu; ·Uống thêm 2 viên nữa vào thời điểm 8 giờ sau liều thứ nhất; ·Uống 2 viên vào buổi sáng và 2 viên vào buổi tốt trong 2 ngày tiếp theo. Đối với trẻ em nhỏ hơn 16 tuổi và cân nặng từ 5 - 15kg: ·Uống 1 viên như một liều khởi đầu; ·Uống thêm 1 viên nữa vào thời điểm 8 giờ sau liều thứ nhất; ·Uống 1 viên vào buổi sáng và 1 viên vào buổi tốt trong 2 ngày tiếp theo. Không có thuốc sốt rét nào có hiệu quả đến 100% tất cả các ca trong điều trị sốt rét. Để có kết quả tốt nhất, hãy sử dụng thuốc đúng chỉ định. Bảo quản thuốc Coartem trong nhiệt độ phòng, tránh xa ẩm và nhiệt độ quá cao. Nếu dùng nhầm liều mà nhận ra càng sớm càng tốt bởi bệnh nhân thì cần cân nhắc liều tiếp theo và báo ngay với bác sĩ của bạn và không nên tự ý uống thêm liều nếu không không được phép của bác sĩ hoặc dược sĩ của bạn Nếu dùng thuốc quá liều hãy gọi số điện thoại sau để tư vấn cấp cứu “Poison Help line at 1-800-222-1222. Trái cái loại nho hoặc nước ép nho có thể tương tác với thuốc Coartem và có thể dẫn đến các tác dụng ngoại ý. Tránh sử dụng thuốc cùng với các sản phẩm từ nho khi dùng thuốc Coartem. Một số biến cố bất lợi khi dùng thuốc CoartemHãy nhờ đến trợ cấp cứu nếu bạn có bất kỳ dấu hiệu nào trong số các phản ứng di ứng sau đây khi dùng Coartem như mày đay, nhịp tim nhanh, khó thở, sưng phồng môi, mặt, lưỡi và cổ họng và hãy gọi ngay cho bác sĩ một khi bạn có các biến cố bất lợi nghiêm trọng như: -Các triệu chứng sốt rét trở nên nặng hơn; -Nôn nặng hơn và chán ăn hơn, tiêu chảy nghiêm trọng không kiểm soát được; -Nhức đầu và đau ngực và chóng mặt dữ dội, choáng, ngất, nhịp tim nhanh bất thường; -Các dấu hiệu ban đầu trên vùng da như phát ban đỏ, từ nhẹ đến trung bình; -Đau thượng vị hoặc đau dạ dày; -Nước tiểu đổi màu hoặc phân đi ra màu đất sét; Hãy gọi ngay cho bác sĩ nếu xuất hiện các triệu chứng sốt, rét run, đau mình mẩy, nhức đầu nhiều, triệu chứng cúm sau khi đã dùng hết liệu trình thuốc Coartem. Một số tác dụng ngoại ý của Coartem gồm có: ·Yếu cơ thể hoặc chóng mặt, lảo đảo, nhức đầu nhẹ; ·Đau khớp và đau cơ; ·Ho. Trên đây không phải là một danh sách đầy đủ các tác dụng ngoại ý hoặc biến cố bất lợi của thuốc Coartem, có thể còn một số biến cố bất lợi khác có thể xảy ra. Hãy gọi cho bác sĩ của bạn để xin lời khuyên y tếhỏi về biến cố bất lợi. Bạn có thể báo cáo các biến cố bất lợi đến FDA theo 1-800-FDA-1088. Độ an toàn và tính dung nạp của thuốc Coartem đã được nghiên cứu trên cả bệnh nhân người lớn và trẻ em. Các biến cố bất lợi và phản ứng tác dụng ngoại ý được báo cáo thường xuyên trên ≥ 10% ở các bệnh nhân người lớn (?) Các tác dụng ngoại ý hay biến cố bất lợi xảy ra với tần suất xảy ra trên ≥10% số bệnh nhi -Trong các thử nghiệm lâm sàng, tỷ lệ phải gián đoạn bệnh nhân không dùng thuốc nữa do các biến cố bất lợi khi dùng thuốc Coartem liệu trình đúng 6 liều chung là 1,1%, trong đó 0,2% (1/647) trên người lớn và 1,6% (21/1332) trên các bệnh nhi; -Các biến chứng bất lợi trên các bệnh nhân người lớn (> 30%) gồm có nhức đầu, chán ăn, chóng mặt, suy nhược, đau khớp, đau cơ. Các biến cố bất lợi thường xảy ra trên trẻ em (>12%) gồm có sốt, ho, buồn nôn, ho, chán ăn, nhức đầu; -Dùng đồng thời sẽ dẫn đến ảnh hưởng lên hệ CYP3A4 như các thuốc rifampin, carbamazepine, phenytoin khi dùng cùng với Coartem có thể đưa đến giảm nồng độ artemether và/ hoặc lumefantrine và sẽ mất đi hoạt tính chống sốt rét đầy đủ; -Coartem không nên dùng trên các bệnh nhân đã biết trước vấn đề tim mạch khoảng QT kéo dài, các bệnh nhân có hạ kali máu hay hạ magne máu và các thuốc khác có thể gây khoảng QT kéo dài; -Halofantrine và Coartem không nên chỉ định trong một tháng do tiềm năng dẫn đến khoảng QT kéo dài. Do các dữ liệu an toàn thuốc còn hạn chế, nên thuốc Coartem không nên chỉ định đồng thời với các thuốc sốt rét khác, trừ khi có ý kiến điều trị thay đổi; -Các thuốc gây QT kéo dài, gồm quinin và quinidin, do vậy cần thận trọng khi dùng cùng hoặc sau khi dùng Coartem; -Các chất nền, các chất ức chế hoặc chất dẫn truyền của CYP3A4, gồm có thuốc ức chế protease chống virus HIV và các chất ức chế sao chép ngược loại non-nucleoside nên dùng thận trọng với thuốc Coartem do nguy cơ mất đi tiềm năng hiệu lực các thuốc lẫn nhau và sẽ dẫn đến kéo dài thời gian QT; -Chất ức chế CYP3A4 nên dùng thận trọng do có khả năng gây QT kéo dài khi dùng đồng thời với thuốc Coartem. Nếu mefloquine được dùng đồng thời ngay trước khi điều trị, cần giám sát tình trạng giảm hiệu lực của Coartem và khuyên bệnh nhân nên ăn rồi hãy uống thuốc; -Sử dụng các thuốc chống virus sao chép ngược như HIV cần thận trọng do tiền năng thuốc dẫn đến kéo dài khoảng QT, mất hiệu lực thuốc chống virus, hoặc mất hiệu lực thuốc chống sốt rét Coartem. Các bệnh nhân dùng cơ chất CYP2D6 nên đươc giám sát các biến có bất lợi và nguy cơ khoảng QT kéo dài trên điện tâm đồ. Các bệnh nhân sử dụng thuốc ngừa thai dạng hormone nên dùng thêm các biện pháp ngừa thai khác để đảm bảo; -Các biến cố bất lợi thường gặp nhất trên bệnh nhân là người lớn (> 15%) gồm có nhức đầu, chán ăn, chóng mặt, suy nhược, đau cơ, buồn nôn, sốt, rét run, đánh trống ngực, mệt, đau bụng, đau khớp, rối loạn giấc ngủ; -Trong khi đó, các biến cố bất lợi hay gặp nhất trên bệnh nhi (> 15%) gồm có sốt, ho, nôn mửa; -Các biến cố bất lợi sau đây được xác định trong suốt quá trình sau khi thuốc Coartem được chấp thuận dùng, gồm có: quá mẫn như mày đay, phù mạch hay phản ứng da nghiêm trọng như vở các mụn rộp nước hiếm khi đươc ghi nhận; Những thuốc nào ảnh hưởng lên tác dụng của Coartem? (trích từ Drugs.com)Nhiều loại thuốc có thể tương tác đến thuốc Coartem. Không phải tất cả đều có thể xảy ra tương tác được liệt kê dưới đây. Nói cho bác sĩ của bạn biết về các thuốc bạn đang dùng và bất cứ lúc nào bạn bắt đầu dừng thuốc trong quá trình điều trị thuốc Coartem, đặc biệt: -Thuốc kháng sinh hoặc thuốc chống lao; -Thuốc chống trầm cảm; -Thuốc chống loạn thần kinh; -Thuốc điều trị rối loạn nhịp tim; -Thuốc điều trị HIV/AIDS; -Thuốc điều trị động kinh hoặc thuốc điều trị đau dây thần kinh ở vùng mặt. Đây không phải là danh sách đầy đủ các thuốc có tính chất tương tác mà còn nhiều loại thuốc khác có thể tương tác với Coartem. Danh sách này thuộc các thuốc có kê đơn hoặc không cần kê đơn, vitamin, các thảo dược. Hiệu lực và tính an toàn của Coartem trong điều trị sốt rét thường do P. falciparum Nhóm tác giả Falade C và cộng sự (2005) đánh giá hiệu lực và tính an toàn của thuốc artemether-lumefantrine (Coartem) viên nén trên các trẻ em và trẻ nhỏ châu Phi mắc sốt rét cấp, không biến chứng do P. falciparum. Thuốc Coartem (co-artemether), gồm có thành phần artemether 120 mg với lumefantrine 20 mg, cho 4 liều cho thấy hiệu quả điều trị trên các trẻ em ở nhiều quốc gia khu vực cân sa mạc Sahara, châu Phi. Tuy nhiên, liệu trình này được coi là chưa đủ đối với các trẻ chưa có miễn dịch và chưa phù hợp tại các vùng có đa kháng thuốc do P. falciparum. Một nghiên cứu nhãn mở đánh giá hiệu lực và tính an toàn của thuốc co-artemether trên 310 trẻ em châu Phi cân nặng từ 5-25 kg, mắc sốt rét cấp, không biến chứng do P. falciparum. Tổng cộng 6 liều thuốc co-artemether được chỉ định trong 3 ngày, theo dõi 7, 14 và 28 ngày. Sau điều trị cho thấy làm sạch nhanh chóng ký sinh trùng và căt sốt. Tỷ lệ chữa khỏi 28 ngày là 86,5% và 93,9% khi hiệu chỉnh bằng PCR đối với các trường hợp tái nhiễm. Tỷ lệ chữa khỏi tại thời điểm 7 và 14 ngày vượt 97% (chưa hiệu chỉnh) và vào ngày 28 tương tự nhau trên các trẻ (5 - < 10 kg) trước đây có phơi nhiễm sốt rét (miễn dịch một phần: 88,6% chưa hiệu chỉnh; 93,3% đã hiệu chỉnh) và những trẻ không có miễn dịch (82,5% chưa hiệu chỉnh; 95% đã hiệu chỉnh). Các biến cố bất lợi hầu như nhẹ. Không có bằng chứng gây độc trên điện tâm đồ, liệu trình thuốc co-artemether 6 liều đã cho thấy cắt nhanh ký sinh trùng và tỷ lệ chữa khỏi cao, thuốc an toàn và dung nạp tốt. Một nghiên cứu so sánh đánh giá hiệu lực và tính an toàn của thuốc artemether-lumefantrine và dihydroartemisinin-piperaquine trong điều trị sốt rét chưa biến chứng do Plasmodium falciparum trên các trẻ em Kenya dưới 5 tuổi qua một nghiên cứu ngẫu nhiên, nhãn mở. (Ogutu và cs., 2014) nhằm tìm ra bằng chứng để đưa thuốc AL như một thuốc điều trị ưu tiên và DHA-PPQ như thuốc điều trị thay thế tại Kenya. Với tổng số 454 trẻ em từ 5 tháng đến 59 tháng mắc sốt rét chưa biến chứng do P. falciparum được chọn ngẫu nhiên (1:1) nhận điều trị AL hoặc DHA-PPQ, theo dõi 42 ngày. Các thông số về hiệu lực đáp ứng lâm sàng và ký sinh trùng đầy đủ (ACPR) vào ngày D28 và các thông số khác đánh giá vào các ngày 14, 28 và 42. Sự chấp thuận và tính dung nạp được đánh giá trên cả hai thuốc thông qua người chăm sóc trẻ với bộ câu hỏi. Kết quả cho thấy, vào ngày D28, tỷ lệ ACPR có hiệu chỉnh bằng PCR đối với thuốc AL và DHA-PPQ lần lượt 97,8% (95% CI: 94.9-99.3) và 99,1% (95% CI: 96.8-99.9), không có sự khác biệt giữa các phác đồ điều trị. Bên cạnh đó, tỷ lệ chữa khỏi sau hiệu chỉnh PCR cũng không khác biệt vào các ngày 14 và ACPR vào ngày D42 đối với AL (100%; 96,8%) và DHA-PPQ (100%; 98,7%). Tương tự, tỷ lệ chữa khỏi khi chưa hiệu chỉnh PCR không có sự khác biệt khi đánh giá vào các thời điểm các ngày D3, 14, 28 và D42 đối với AL dispersible (99,1%; 98,7%; 81,1%; 67,8%) và DHA-PPQ (100%; 100%; 87,7%; 70,5%). Làm sạch ký sinh trùng nhanh, khoảng 90% số ký sinh trùng sạch trong vòng 40 giờ ở cả hai phác đồ. Các biến cố bất lợi được ghi nhận, chỉ có 1 biến cố bất lợi nghiêm trọng xảy ra trên nhóm AL (0,42%) không liên quan đến nghiên cứu. Sự chấp thuận điều trị cao hơn ở nhóm trẻ em dùng AL (93,6%) so với nhóm dùng DHA-PPQ (85,6%) có ý nghĩa thống kê. Do vậy, qua nghiên cứu này cho thấy cả AL và DHA-PPQ đều dung nạp tốt và có hiệu lực cao cũng như không tìm thấy tỷ lệ tái phát ký sinh trùng. Một nghiên cứu đánh giá về mặt hiệu lực và tính an toàn của artemether-lumefantrine trong điều trị sốt rét chưa biến chứng theo 3 chế độ liều hóa dự phòng (James Kapisi và cs., 2015). Theo các tác giả cho biết, gánh nặng sốt rét rất cao ở trên các trẻ em tại các quốc gia châu Phi mặc dù đã sử dụng màn tẩm hóa chất (ITNs). Hóa dự phòng tỏ ra có tiềm năng làm giảm gánh nặng sốt rét. Tuy nhiên, dữ liệu về tính an toàn và hiệu quả cần phải đánh giá. Với tổng số 600 trẻ em tuổi từ 4-5 tháng đươc đưa vào nghiên cứu ở Tororo, Uganda. Các bệnh nhi tham gia đều được cấp màn tẩm hóa chất và các người chăm sóc trẻ được hướng dẫn chăm trẻ tại điểm nghiên cứu khi chúng bị bệnh . Bắt đầu từ 6 tháng tuổi, 579 trẻ được chọn ngẫu nhiên không cho hóa dự phòng, dùng sulphadoxine-pyrimethamine (SP) hàng tháng, trimethoprim-sulphamethoxazole (TS) hoặc ngày hoặc dihydroartemisinin-piperaquine (DHA-PPQ) hàng tháng. Thuốc nghiên cứu chỉ định không có theo dõi tại nhà cho đến khi được 24 tháng tuổi. Các cơn sốt rét không biến chứng được điều trị bằng thuốc artemether-lumefantrine (AL) theo dõi 28 ngày. Nguy cơ xuất hiện các cơn sốt rét lại trong vòng 84 ngày và nguy cơ các biến cố bất lợi trong vòng 28 ngày được so sánh trong suốt nghiên cứu, sử dụng mô hình phân tích Cox proportional hazards model và phương trình ước tính. Kết quả cho thấy tổng số 1.007, 919, 736 và 451 đợt sốt rét được điều trị không có hóa dự phòng lần lượt SP, TS và DHA-PPQ. Chỉ có 19 (0,6%) ca điều trị với sốt rét ác tính. Đáp ứng sớm với liệu pháp AL là tuyệt đối cao nhất với 96,5% cắt sốt và 99,4% sạch ký sinh trùng vào ngày D3. Tuy nhiên, trên 50% số liều điều trị AL được theo dõi qua sự xuất hiện lại ký sinh trùng trong vòng 28 ngày. So với nhánh không dùng hóa dự phòng, nguy cơ tích lũy tái xuất hiện ký sinh trùng trong vòng 84 giờ sau điều trị bằng AL thấp hơn có ý nghĩa so với nhóm dùng DHA-PPQ (harzard ratio 0,77, 95% CI 0.63-0.95, p = 0,01) nhưng không nhóm SP hay TS. Kết luận rằng nguy cơ sốt rét ác tính rất thấp trên nghiên cứu thuần tập này tại vùng sốt rét lan truyền cao này. Với hóa dự phòng, thì sốt rét chưa biến chứng điều trị với AL an toàn và hiệu quả, bảo vệ ngăn các cơn sốt rét tái xuất hiện trên các trẻ em dùng DHA-PPQ hàng tháng. Một nghiên cứu của nhóm Bassat Q, Mulenga M, Tinto H, Piola P, Borrmann S, và cộng sự (2009) so sánh hiệu lực hai phác đồ DHA-PPQ và AL trong điều trị các ca sốt rét không biến chứng trên các trẻ em châu Phi - một nghiên cứu ngẫu nhiên, không ưu thế hiệu lực giữa hai phác đồ DHA-PPQ so với artemether-lumefantrine (AL) trên các trẻ từ 6-59 tháng tuổi mắc sốt rét không biến chứng do P. falciparum tại 5 quốc gia châu Phi là Burkina Faso, Kenya, Mozambique, Uganda và Zambia. Các bệnh nhân được chọn ngẫu nhiên theo tỷ lệ 2:1 để nhận thuốc hoặc DHA-PPQ hoặc thuốc AL. Không đánh giá hơn kém sử dụng một phạm vi 25% giới hạn dưới 1 bên với CI 97,5% khác biệt điều trị (DHA-PPQ so với AL) trong vòng 28 ngày theo dõi có hiệu chỉnh PCR đánh giá tỷ lệ chữa khỏi. Phân tích hiệu lực được tiến hành trên một số quần thể và 2 trong số chúng được trình bày ở đây intention-to-treat (ITT) và enlarged per-protocol (ePP). 1553 trẻ được chọn ngẫu nhiên, 1039 trẻ dùng thuốc DHA-PQP và 514 trẻ dùng AL. Tỷ lệ chữa khỏi sau hiệu chỉnh PCR là 90,4% (ITT) và 94,7% (ePP) trên nhóm dùng DHA-PQP và 90% (ITT) và 95,3% (ePP) trên nhóm dùng AL. Giới hạn dưới một bên với CI = 97.5% sự khác biệt giữa hai phác đồ điều trị lần lượt là 22,8% và 22,96% trên quần thể ITT và ePP. Trên quần thể ITT, ước tính Kaplan-Meier dẫn đến nhiễm mới đến ngày D42 là 13,55% (95% CI: 11.35%-15.76%) đối với DHA-PQP so với 24% (95% CI: 20.11%-27.88%) đối với AL (p = 0,0001). Điều này cho thấy DHA-PQP là thuốc có hiệu lực tương tự như AL trong điều trị sốt rét chưa biến chứng trên các trẻ em châu Phi đến từ các vùng sốt rét khác nhau, sự hình thái nhiễm mới trong vòng 42 ngày thấp hơn ở nhóm dùng DHA-PQP, điều đó cho thấy thuốc này có hiệu quả dự phòng sau điều trị kéo dài hơn so với AL. Nghiên cứu do nhóm tác giả Yeka Adoke và cộng sự (2015) đánh giá hiệu lực và tính an toàn của thuốc phối hợp Artesunate-Amodiaquine (ASAQ) so với Artemether-Lumefantrine (AL) trong điều trị lặp lại sốt rét chưa biến chứng Plasmodium falciparum trên các trẻ em Uganda, nhưng hiệu quả của liều lặp lại kéo dài chưa có số liệu. Các nhà nghiên cứu tiến hành một thử nghiệm thử nghiệm lâm sàng pha IV, theo dõi dọc, ngẫu nhiên, nhãn mở trong vòng 2 nămso sánh hiệu lực và độ an toàn của ASAQ và AL điều trị lặp lại sốt rét không biến chứng trên các trẻ em dưới 5 tuổi ở Trung tâm y tế Nagongera, Uganda. Các trẻ tham gia ngẫu nhiên dùng ASAQ hoặc AL và tất cả ca bệnh đến sau đó đều được điều trị liệu trình như nhau. Tổng số 413 trẻ được đưa vào nghiên cứu và tổng số có 6.027 cơn sốt rét (trung bình 15; khoảng 1-26). Đối với cơn sốt rét đầu tiên, tỷ lệ chữa khỏi hiệu chỉnh bằng PCR đối với ASAQ (97,5%) không hơn so với AL (97,0%; 95% CI [20.028; 0.037]). Tỷ lệ chữa khỏi sau hiệu chỉnh PCR đối với những cơn sốt rét sau đó hơn 100 ca (cơn 2-18), dao động từ 88,1% đến 98,9% mỗi cơn, không có sự khác biệt rõ ràng giữa các nhóm dùng thuốc. Ký sinh trùng được làm sạch hoàn toàn vào ngày D3 đối với tất cả cơn sốt rét và người mang giao bào < 1% vào ngày thứ 21. Thời gian cắt sốt nhanh hơn ở nhóm dùng ASAQ đối với cơn sốt đầu tiên. Sự chấp thuận điều trị đối với các cơn sốt rét sau đó gần 100%. Các biến cố bất lợi thông thường đều tương tự giữa các nhóm điều trị và hầu như có liên quan đến bệnh. Thiếu máu và giảm bạch cầu xảy ra trong 0,5% số ca, chức năng gan bất thường trên 0,3-1,4% số ca. Cả hai liệu trình đều an toàn và hiệu quả để điều trị lặp lại cơn sốt rét. Một nghiên cứu tiếp theo đánh giá liệu trình 6 liều của Coartem được đánh giá trong 6 nghiên cứu ở 4 lục địa. Đánh giá hiệu lực thuốc Coartem trên các bệnh nhân sốt rét cấp tính không biến chứng do P. falciparum và xét nghiệm HIV (-) qua 6 thử nghiệm lâm sàng 6 liều của thuốc Coartem. Sốt rét chưa biến chứng được xác định khi nhiễm P. falciparum có triệu chứng nhưng không có triệu chứng sốt rét ác tính hay rối loạn chức năng cơ quan. Coartem® (artemether/lumefantrine) được chỉ định điều trị trên những ca sốt rét cấp, không biến chứng do Plasmodium falciparum cân nặng từ 5kg trở lên và có hiệu quả trên các vùng địa lý khác nhau. Các nghiên cứu 6 liều được tiến hành trên các các bệnh nhân nhi và người lớn trưởng thành không có miễn dịch hoặc miễn dịch một phần có cân nặng từ ≥5 kg tại một số vùng ở châu Phi, châu Á, châu Âu và Nam Mỹ. Các bệnh nhân có đặc điểm lâm sàng SRAT hoặc suy chức năng gan, thận, tim mạch bị loại khỏi nghiên cứu, tuổi bệnh nhân từ 2 tháng đến 71 tuổi. - Nghiên cứu 3 tiến hành trên bệnh nhân ≥ 2 tuổi, liệu trình 6 liều (n = 118) dùng Coartem;
- Nghiên cứu 4, tổng số 150 bệnh nhân gồm người lớn và trẻ em ≥ 2 tuổi dùng Coartem;
- Nghiên cứu 5, tổng số 164 bệnh nhân người lớn và trẻ em ≥ 12 tuổi dùng Coartem;
- Nghiên cứu 6 với 165 bệnh nhân người lớn không có miễn dịch sống tại vùng không có lưu hành sốt rét nhiễm P falciparum chưa biến chứng có tiền sử đến vùng sốt rét lưu hành;
- Nghiên cứu 7 trên 310 bệnh nhân trẻ em nhỏ và trẻ em, từ 2 tháng đến 9 tuổi, cân nặng từ 5 kg - 25 kg, có thân nhiệt ≥ 37,5°C;
- Nghiên cứu 8 tiến hành trên 452 trẻ em nhỏ và trẻ em tuổi từ 3 tháng đến 12 tuổi, cân nặng 5 kg - < 35kg, có sốt (≥ 37.5°C nách hoặc ≥ 38°C ở trực tràng) hoặc tiền sử sốt trong 24 giờ trước đó.
Coartem là liệu pháp điều trị có tỷ lệ chữa khỏi dao động từ 88% đến 97% trong nghiên cứu thử nghiệm lâm sàng liệu trình 3 ngày với 6 liều điều trị. Tổ chức Y tế thế giới cảnh báo thuốc Coartem giả trên thị trường 2013Tổ chức Y tế thế giới (TCYTTG) ra một bản thông báo về loại thuốc nhái giả mạo của Coartem đang lưu hành tại Cameroon. Coartem là một thuốc phối hợp liều dựa trên nền tảng thuốc ACTs dùng để điều trị sốt rét. Các mẻ thuốc giả được phát hiện gần đây trong các bệnh viện và chợ trời. Cảnh báo thuốc Coartem giả của TCYTTG là một phiên bản cập nhật ấn bản vào tháng 5.2013 lưu hành tại các vùng của Trung và Tây Phi, một phần thông báo bởi cơ quan tình báo của Joint Inter-Agency Task Force (JIATF). Nhóm hành động này tiến hành trên Global Fund's Office of the Inspector General (OIG), USAID OIG và UNDHA-PPQ's Office của các quan sát viên và điều tra viên, truy tìm thủ phạm, các vụ thuốc giả của Global Fund and USAID-funded medicines. Ít nhất 4 mẻ thuốc được xác định (NOF 2153, F2929 và F2261) mang logo màu xanh lá cây của chương trình sốt rét Affordable Medicines Facility, tài trợ kinh phí bởi Global Fund. Số lượng các mẻ thuốc giả đều có thể xác định và tìm thấy mẫu tại trung tâm cảnh báo của TCYTTG. Các nhóm thành viên của quỹ Toàn cầu có liên quan cũng như cơ quan Drug Regulatory Authorities quốc gia đã cảnh báo và OIG đang làm việc chặt chẽ với đối tác JIATF chính của USAID, cũng như công ty dược Novartis để xây dựng đơn vị tình báo về phòng chống thuốc giả xâm nhập vào dây chuyền thuốc của tập đoàn dược này. Văn phòng Inspector General làm việc để đảm bảo rằng đầu tư của Quỹ toàn cầu vào đều có hiệu quả nhất để chống lại các căn bệnh thời đại AIDS, lao và sốt rét. Mặc dù có thanh tra, giám sát và kiểm tra chặt chẽ nhưng cũng cần phải đưa ra các khuyến cáo để thúc đẩy thực hành tốt, giảm nguy cơ. Thành lập năm 2005, Văn phòng giám sát Inspector General là một cơ quan độc lập của Quỹ Toàn cầu. Chịu trách nhiệm giải thích với cơ quan thanh kiểm tra và hội đồng đạo đức và đóng vai trò đối tác lợi nhuận của Quỹ Toàn cầu. Làm sao cho phù hợp với tiêu chuẩn quốc tế để thực hành chuyên môn của thanh tra nội bộ và hướng dẫn đồng bộ trong thanh tra, giám sát,…chuyên biệt. Novartis giới thiệu một công thức thuốc sốt rét mới cho Coartem 80/480 tại Kenya Công ty Novartis đã cho ra đời một công thức thuốc sốt rét có chất lượng cao đối với thuốc Coartem 80/480 (artemether/lumefantrine 80 mg/480 mg) để điều trị ca sốt rét chưa biến chứng trên các trẻ em và người lớn có cân nặng trên 35kg. Thuốc đã được đăng ký bởi cơ quan dược và độc chất tại Kenya, và hiện nay sẵn sàng đưa sang Nigeria và Angola. Kenya là quốc gia thứ 3 tại châu Phi dùng Coartem 80/480. Các quốc gia khác đã đăng ký trước đây với thuốc Coartem 80/480mg là Uganda và Ghana. Trong liệu trình dùng hai lần mỗi ngày để tăng sự chấp thuận hoặc hài lòng cho bệnh nhân (compliance) với liệu trình dùng, do đó liệu trình điều trị đầy đủ từ 24 viên xuống còn 6 viên, nghĩa là giảm đi 75% gánh nặng về viên thuốc. Novartis liên kết với Kenya các quốc gia còn lại của châu Phi đạt mục tiêu trong việc chống lại bệnh sốt rét. Theo tiến sĩ Nathan Mulure, quản lý y khoa của Novartis tại châu Phi cho biết sốt rét là căn bệnh có thể phòng được và chữa khỏi rất cao, tuy nhiên nó vẫn là căn bệnh gây chết người nhiều nhất tại các quốc gia đang phát triển. Novartis xác định lại và cam kết mạnh với cuộc chiến chống lại sốt rét, điều này sẽ giúp điều tị và giảm gánh nặng cho bệnh nhân sốt rét. Việc ra đời các thuocs Coartem hàm lượng 80/480 mg tại Kenya đánh dấu một thành công mới trong cuộc chiến chống lại sốt rét và sẽ có lợi cho bệnh nhân khi được điều trị với các thuốc có hiệu lực cao và chất lượng. Thuốc Coartem 80/480 mg lần đầu tiên đăng ký tại Thụy Sĩ bởi cơ quan y tế - Swiss Medic. Novartis tiên phong trong việc ra mắt các ACTs liều phối hợp (fixed-dose ACT) và 10 năm sau đó, năm 2009 , lần đầu tiên có thể phân phối ACT để hội đủ nhu cầu cho trẻ em có nguy cơ mắc sốt rét nhất. Thông qua một đối tác của TCYTTG năm 2001, họ là công ty đầu tiên trong ngành công nghiệp chăm sóc y tế cam kết cung cấp thuốc điều trị sốt rét đến hệ thống y tế công tại các quốc gia có sốt rét lưu hành phi lợi nhuận - tiến sĩ Nathan Mulure cho biết. Kể từ năm 2006, Kenya đã tiếp nhận trên 75 triệu liều điều trị Coartem. Do đó, Kenya là một quốc gia tiếp nhận thuốc Coartem lớn nhất. Mỗi năm có hơn một triệu ca chết có liên quan đến sốt rét trên toàn thế giới. Hơn 90% số ca tử vong xảy ra ở khu vực cận sa mạc Sahara, châu Phi và phần lớn số ca sốt rét chết ở trẻ em. Chỉ tính riêng châu Phi cứ mỗi 60 giây có một trẻ chết vì có liên quan đến sốt rét. Như một phần cam kết với bệnh nhân cũng như giới chức y tế, Novartis cũng cung cấp các chương trình giáo dục sức khỏe đến quản lý ca bệnh, điều này bao gồm tập huấn cầm tay chỉ việc (hands-on training) cho các nhân viên y tế địa phương, cẩm nang đào tạo và gói y tế dễ sử dụng để đảm bảo rằng thuốc Coartem và phân phối Coartem sử dụng hợp lý và nâng cao sự chấp thuận của bệnh nhân. Novartis và Kenya có một mối quan hệ lâu dài. Đến nay, Novartis cho triển khai các chương trình cải tiến về lĩnh vực ung thư, cấy ghép, sốt rét, tiếp cận y tế cho bệnh nhân tại các vùng nông thôn và xây dựng nâng cao năng lực nghiên cứu và phát triển với mục đích trở thành công ty chăm sóc sức khỏe hàng đầu tại quốc gia này. Trong lĩnh vực ung thư, Novartis đã thiết lập một chương trình tiếp cận bệnh nhân toàn cầu, làm việc cùng với giới chức địa phương bệnh viện Nairobi để điều trị các bênh ung thư bạch cầu man tính dòng tủy (CML). Trong chương trình Glivec International Patients Assistance Program (GIPAP), Novartis trợ cấp toàn bộ chi phí thuốc ung thư cho 450 bệnh nhân Kenya mắc CML cần thuốc điều trị. Để đáp ứng một số lượng lớn chăm sóc y tế trong lĩnh vực ghép thận, các đối tác Novartis với bệnh viện Kenyatta National Hospital và các chuyên gia phẩu thuật tại Tây Ban Nha để xây dựng một trung tâm chuyên ghép thận tại Kenya cũng như khắp Đông Phi. Thông qua chương trình Interlife, năng lực ghép thận của họ đã cải thiện và nâng coa đáng kể và trên 110 bệnh nhân đã được tiến hành ghép thận. Giờ đây, vẫn tiếp tục có nhu cầu gia tăng tiến hành ghép thận tại Kenya ngày một nhiều hơn. Novartis đã góp phần lớn vào việc làm giảm gánh nặng sốt rét tại Kenya, đây cũng là một quốc gia được nhận thuốc Coartem lớn nhất. Công ty đã phân phối đến trên 75 triệu liều điều trị Coartem phi lợi nhuận đến y tế công cộng của Kenya kể từ năm 2006. Từ năm 2010, tham gia mở rộng tiếp cận các thuốc ACTs chất lượng cao đến hệ thống y tế tư nhận thông qua chương trình Affordable Medicines Facility for Malaria (AMFm) và từ năm 2012, thông qua một chương trình tiếp cận y tế tư nhân tên gọi là dự án NPP. Để gia tăng tiếp cận thuốc tại các vùng nông thôn, Novartis đã khởi động Familia Nawiri (Swahili for healthy families) - một chương trình tập trung vào các thuốc thiết yếu với giá ưu đãi. Năm 2013, chương trình mở rộng đến 20 vị trí tại 10 quốc gia của Trung, Tây, Nyanza và Nam Rift của Kenya, bao phủ một lượng dân số khoảng 700.000 người. Cuối cùng, Novartis cũng làm việc với Viện Nghiên cứu y khoa Kenya để xây dựng năng lực thử nghiệm lâm sàng, đào tạo, nghiên cứu và phát triển tại Kenya. Các dự án bao gồm một thử nghiệm lâm sàng và một hội thảo Phase 1, một mô hình toán học và một kinh phí tài trợ cho các nhà khoa học Kenya tham gia vào nghiên cứu tại Basel và Cambridge được thiết kế để đào tạo các thế hệ những nhà khoa học tiếp nối của của Kenya (“Next Generation of Scientists in Africa”). Năm 2001, công ty Novartis ký văn bản ghi nhớ với TCYTTG để cung cấp phi lợi nhuận thuốc Coartem đến các vùng có sốt rét lưu hành trên khắp thế giới. Kể từ đó, Coartem đã phát triển từ 100.000 liều điểu trị mỗi năm lên đến 100 triệu liều điều trị vào năm 2011. Novartis là công ty đầu tiên phát triển thuốc thận thiện đạt chất lượng cho trẻ em đạt chuẩn của TCYTTG (WHO prequalified child friendly medication) về phân phối thuốc Coartem. Các viên thuốc phân phối đến trẻ em dễ dàng bẻ gãy cho vào trong nước, có vị ngọt và dễ uống. Hai vùng ở Kenya tham gia vào trong thử nghiệm phase 3 thuốc Coartem. Kể từ năm 2009, hơn 200 triệu liều thuốc Coartem phân bổ đến phần lớn các quốc gia châu Phi. Sự phân bổ Coartem liên kết phần lớn bởi công ty Novartis và MMV (Medicines for Malaria Venture) trong thực thi nhiệm vụ giảm gánh nặng sốt rét tại các quốc gia đang phát triển thông qua khám phá, nghiên cứu, phát triển và hỗ trợ phân bổ các thuốc sốt rét mới có hiệu quả. Cùng với Viện nghiên cứu y học nhiệt đới Thụy Sĩ (Swiss Tropical Institute) và tập đoàn Novartis Foundation nghiên cứu dự án ALIVE tiếp tục phát triển tốt và lớn mạnh, mang lại lợi điểm cho người dân tại các vùng Đông Phi. Dự án này gia tăng tiếp cận các thuốc có chất lượng cao và đăng ký thành công thuốc trong những năm qua. Coartem là thuốc duy nhất FDA chấp thuận ACTs tại Mỹ và là thuốc đầu tiên được chứng nhận bởi cơ quan đánh giá y học châu Âu (European Medical Evaluating Agency_EMEA). Đây là một sự chứng thực về chất lượng thuốc hội đủ tiêu chuẩn nghiêm ngặt và Coartem tiếp tục cho thấy hiệu lực cao trong nghiên cứu lâm sàng và nghiên cứu thực hành. Novartis tìm kiếm để mở rộng các cải thiện tiếp cận y tế tại châu Phi và cho ra đời các thuốc mới đến Kenya và các vùng lưu hành khác. Ngoài ra, các chương trình khác cũng chịu trách nhiệm như Novartis Malaria Initiative, Novartis sẽ tìm kiếm để tăng sự có mặt và uy tín của họ ở Kenya vào năm 2014. Trong việc hợp nhất các tổ chức quốc tế, Novartis đã cung cấp hơn 600 triệu liều thuốc Coartem đến hệ thống y tế của châu Phi mà không cần lợi nhuận kể từ năm 2001. Artemisinin là một hợp chất chiết xuất từ cây cỏ ngọt và đã sử dụng trong nhiều thế kỷ qua trong y học cổ truyền Trung Hoa để điều trị sốt. Thuốc ACTs là phối hợp hai hay nhiều loại thuốc với nhau trong đó có thành phần dẫn suất artemisinin theo các phương thức tác dụng khác nhau. Các nghiên cứu đã chỉ ra sử dụng hai hay nhiều loại thuốc trong một phối hợp có tiềm năng và đóng vai trò làm chậm sự hình thành kháng thuốc. Đặc biệt, ACTs cho thấy có hiệu quả cao trong điều trị sốt rét và làm chấm phát triển kháng thuốc tại các vùng lan truyền bệnh cao. Hiện nay với phối hợp thành phần thuốc nhưng liều lượng trong một viên phối hợp có thể khác gồm Artemether và Lumefantrine đã có nhiều loại biệt dược khác nhau bên cạnh biệt dược chính uy tín Coartem, như Lumefanz, Falcimal LF, Antimal -80, Artyl LF dạng siro, Esther-L dạng siro, Artemefan, Artemether 180mg - Lumefantrine 1080mg dạng siro, Artirin-40, Alar-once, Artemether Plus (hàng Việt Nam), Dorother-L,Falcidoc-L, Hatherley, Malafantrine, Artem, Artemef, Falcynate-LF, Almether, Artil-LF40, Comether, Bimalaril, Artiman-L. Ngoài ra, trên thị trường thế giới còn có những loại thuốc đơn chất dạng tiêm truyền chỉ có thành phần artemether, các nhân viên y tế và bệnh nhân nên thận trọng khi hướng đến các loại thuốc như thế. Tất cả thuốc sốt rét tại mỗi quốc gia hiện nay đều có hướng dẫn chung cụ thể từ bộ y tế và Chương trình phòng chống sốt rét mỗi nước, nên không nên tự ý mua thuốc khi cho phép từ bác sĩ hay dược sĩ. Tài liệu tham khảo 1.Adoke Yeka, Lameyre V, Afizi K, Fredrick M, Lukwago R, et al. (2014). Efficacy and Safety of fixed-dose artesunate-amodiaquine vs. artemether-lumefantrine for repeated treatment of uncomplicated Malaria in Ugandan children. PLoS onE 9(12): e113311. 2.Bernhards R Ogutu, Kevin O onyango, Nelly Koskei et al., (2014). Efficacy and safety of artemether-lumefantrine and dihydroartemisinin-piperaquine in the treatment of uncomplicated Plasmodium falciparum malaria in Kenyan children aged less than five years: results of an open-label, randomized, single-centre study. Malaria Journal 2014, 13:33. 3.Christine Manyando, Eric M Njunju, Mailis Virtanen, Kamal Hamed et al., (2015). Exposure to artemether-lumefantrine (Coartem®) in first trimester pregnancy in an observational study in Zambia. Malaria Journal, 14:77. 4.Falade C, Makanga M, Premji Z, Ortmann CE, Stockmeyer M et al., (2005). Efficacy and safety of artemether-lumefantrine (Coartem) tablets (six-dose regimen) in African infants and children with acute, uncomplicated falciparum malaria. Trans R Soc Trop Med Hyg. 2005 Jun;99(6):459-67. 5.Nairobi et al., (2014). Novartis introduces new anti-malarial formulation, Coartem 80/480mg in Kenya. http://www.Pharmabiz.com 2014. 6.Abdulla S, Sagara I, Borrman S, D’Allessandro U, Gonzalez R, Hamel M, et al. Efficacy and safety of artemether/lumefantrine dispersible tablets compared with crushed commercial tablets in African infants and children with uncomplicated malaria: a randomised, single-blind, multicentre trial. Lancet 2008. 372(9652): p.1819-27. 7.Achan J, Tibenderana JK, Kyabayinze D, Wabwire Mangen F, Kamya MR, Dorsey G, et al. Effectiveness of quinine versus artemether/lumefantrine for treating uncomplicated falciparum malaria in Ugandan children: Randomised trial. British Medical Journal 2009. 339: p. b2763. 8.Adam I, Salah MT, Eltahir HG, Elhassan AH et al., (2010). Dihydroartemisinin-piperaquine versus artemether-lumefantrine, in the treatment of uncomplicated Plasmodium falciparum malaria in central Sudan. Annals of Tropical Medicine and Parasitology. 104(4): p. 319-26. 9.Arinaitwe E, Sandison TG, Wanzira H, Kakuru A, Homsy J, Kalamya J, et al. (2009). Artemether-lumefantrine versus dihydroartemisinin-piperaquine for falciparum malaria: A longitudinal, randomized trial in young Ugandan children. Clinical Infectious Diseases 2009. 49(11): p. 1629-37. 10.Bassat Q, González R, Machevo S, Nahum A et al., (2001). Similar efficacy and safety of artemether-lumefantrine (Coartem(R)) in African infants and children with uncomplicated falciparum malaria across different body weight ranges. Malaria Journal 2011. 10: p. 369. 11.Bassat Q, Mulenga M, Tinto H, Piola P, Borrmann S et al., (2009). Dihydroartemisinin-piperaquine and artemether-lumefantrine for treating uncomplicated malaria in African children: a randomised, non-inferiority trial. PLoS one 2009. 4(11): p. e7871. 12.Bell DJ, Wootton D, Mukaka M, Montgomery J et al., (2009). Measurement of adherence, drug concentrations and the effectiveness of artemether-lumefantrine, chlorproguanil-dapsone or sulphadoxine-pyrimethamine in the treatment of uncomplicated malaria in Malawi. Malaria Journal. 8: p. 204. 13.Borrmann S, Sasi P, Mwai L, Bashraheil M, Abdallah A et al (2011). Declining responsiveness of Plasmodium falciparum infections to artemisinin-based combination treatments on the Kenyan coast. PloS one. 6(11): p. e26005. 14.Bousema JT, Schneider P, Gouagna LC, Drakeley CJ et al., (2006). Moderate effect of artemisinin-based combination therapy on transmission of Plasmodium falciparum. Journal of Infectious Diseases, 2006. 193(8): p. 1151:9. 15.Bukirwa H, Yeka A, Kamya MR, Talisuna A et al (2006). Artemisinin combination therapies for treatment of uncomplicated malaria in Uganda. PLoS Clinical Trials 2006. 1(1): p. e7. 16.Carrara VI, Zwang J, Ashley EA, Price RN, et al., (2009). Changes in the treatment responses to artesunate-mefloquine on the northwestern border of Thailand during 13 years of continuous deployment. PLoS one. 4(2): p. e4551. 17.Carrasquilla G, Baron C, Monsell EM, Cousin M et al., (2012). Randomized, prospective, three-arm study to confirm the auditory safety and efficacy of artemether-lumefantrine in Colombian patients with uncomplicated Plasmodium falciparum malaria. American Journal of Tropical Medicine Hygiene 2012. 86(1): p.75:83. 18.Clark TD, Njama-Meya D, Nzarubara B, Maiteki-Sebuguzi C et al. (2010). Incidence of malaria and efficacy of combination antimalarial therapies over 4 years in an urban cohort of Ugandan children. PLoS one 2010. 5(7): p. e11759. 19.Denis MB, Tsuyuoka R, Lim P, Lindegardh N et al., (2006). Efficacy of artemether-lumefantrine for the treatment of uncomplicated falciparum malaria in northwest Cambodia. Tropical Medicine and International Health 2006. 11(12): p. 1800:7. 20.Dorsey G, Staedke S, Clark TD, Njama-Meya D et al., (2007). Combination therapy for uncomplicated falciparum malaria in Ugandan children: a randomized trial. JAMA 2007. 297(20): p. 2210:9. 21.Espie E, Lima A, Atua B, Dhorda M, Flevaud L (2012). Efficacy of fixed-dose combination artesunate-amodiaquine versus artemether-lumefantrine for uncomplicated childhood Plasmodium falciparum malaria in Democratic Republic of Congo: A randomized non-inferiority trial. Malaria Journal. 11: p. 174. 22.Falade C, Makanga M, Premji Z, Ortmann CE, Stockmeyer M (2005). Efficacy and safety of artemether-lumefantrine (Coartem) tablets in African infants and children with acute, uncomplicated falciparum malaria. Transactions of the Royal Society of Tropical Medicine. 99(6): p. 459:67. 23.Faucher JF, Aubouy A, Adeothy A, Cottrell G et al., (2009). Comparison of sulfadoxine-pyrimethamine, unsupervised artemether-lumefantrine, and unsupervised artesunate-amodiaquine fixed-dose formulation for uncomplicated Plasmodium falciparum malaria in Benin: A randomized effectiveness noninferiority trial. Journal of Infectious Diseases. 200(1): p. 57:65. 24.Faye B, Ndiaye JL, Tine R, Sylla K, Gueye A, et al., (2010). A randomized trial of artesunate mefloquine versus artemether lumefantrine for the treatment of uncomplicated Plasmodium falciparum malaria in Senegalese children. Americal Journal of Tropical Medicine and Hygiene. 82(1): p. 140:4. 25.Faye B, Offianan AT, Ndiaye JL, Tine RC, Toure W, Djoman K, et al., (2009). Efficacy and tolerability of artesunate-amodiaquine (Camoquin plus) versus artemether-lumefantrine (Coartem) against uncomplicated Plasmodium falciparum malaria: multisite trial in Senegal and Ivory Coast. Tropical Medicine and International Health. 15(5): p. 608:13. 26.Gadalla NB, Adam I, Elzaki SE, Bashir S, Mukhtar I et al. Increased pfmdr1 copy number and sequence polymorphisms in Plasmodium falciparum isolates from Sudanese malaria patients treated with artemether-lumefantrine. Antimicrobial Agents and Chemotherapy 2011. 55(11): p. 5408:11. 27.Guthmann JP, Cohuet S, Rigutto C, Fortes F et al., (2006). High efficacy of two artemisinin-based combinations (artesunate-amodiaquine and artemether-lumefantrine) in Caala, Central Angola. America Journal of Tropical Medicine and Hygiene. 75(1): p. 143:5. 28.Hodel EM, Kabanywanyi AM, Malila A, Zanolari B, et al., (2009). Residual antimalarials in malaria patients from Tanzania: An implications on drug efficacy assessment and spread of parasite resistance. PLoS one. 4(12): p. e8184. 29.Hwang J, Alemayehu BH, Hoos D, Melaku Z et al., (2011). In vivo efficacy of artemether-lumefantrine against uncomplicated Plasmodium falciparum malaria in Central Ethiopia. Malaria Journal 2011. 10: p. 209. 30.James Kapisi, Victor Bigira, Tamara Clark, Stephen Kinara et al., (2015). Efficacy and safety of artemether-lumefantrine for the treatment of uncomplicated malaria in the setting of three different chemopreventive regimens. Malaria Journal.14:53. doi 10.1186/s12936-015-0583-9. 31.Juma EA, Obonyo CO, Akhwale WS and Ogutu BR (2008). A randomized, open-label, comparative efficacy trial of artemether-lumefantrine suspension versus artemether-lumefantrine tablets for treatment of uncomplicated Plasmodium falciparum malaria in children in western Kenya. Malaria Journal. 7: p. 262. 32.Kamugisha E JS, Minde M, Kataraihya J, Kongola G, Kironde F and Swedberg G. Efficacy of artemether-lumefantrine in treatment of malaria among under-fives and prevalence of drug resistance markers in Igombe-Mwanza, north-western Tanzania. Malaria Journal 2012. 27. 33.Kamugisha E JS, Minde M, Kataraihya J, Kongola G, Kironde F (2012). Efficacy of artemether-lumefantrine in treatment of malaria among under-fives and prevalence of drug resistance markers in Igombe-Mwanza, north-western Tanzania. Malaria Journal. 27. 34.Kamya MR, Yeka A, Bukirwa H, Lugemwa M et al., (2007). Rwakimari JB, Staedke SG, et al. Artemether-lumefantrine versus dihydroartemisinin-piperaquine for treatment of malaria: a randomized trial. PLoS Clinical Trials. 2(5): p.e20. 35.Karunajeewa HA, Mueller I, Senn M, Lin E, Law I, Gomorrai PS, et al., (2008). A trial of combination antimalarial therapies in children from Papua New Guinea. New England Journal of Medicine. 359(24): p. 2545:57. 36.Laminou I et al., (2011). Randomized, double blind study comparing the therapeutic efficacy and safety of artemether-lumefantrine and artesunate amodiaquine in Gaya, Niger, Malaria journal, 2011 37.Lefevre G, Looareesuwan S, Treeprasertsuk S, Krudsood S et al.(2001). A clinical and pharmacokinetic trial of six doses of artemether-lumefantrine for multidrug-resistant Plasmodium falciparum malaria in Thailand. Americal Journal of Tropical Medicine Hygiene. 64(5-6): p. 247:56. 38.Martensson A, Ngasala B, Ursing J, Isabel Veiga M, et al. (2007). Influence of consecutive day blood sampling on polymerase chain reaction-adjusted parasitological cure rates in an antimalarial drug trial conducted in Tanzania. Journal of Infectious Diseases 2007. 195(4): p. 597:601. 39.Martensson A, Stromberg J, Sisowath C, Msellem MI et al., (2005). Efficacy of artesunate plus amodiaquine versus that of artemether-lumefantrine for the treatment of uncomplicated childhood Plasmodium falciparum malaria in Zanzibar, Tanzania. Clinical Infectious Diseases. 41(8): p. 1079:86. 40.Mayxay M, Khanthavong M, Chanthongthip O, Imwong M (2012). Efficacy of artemether-lumefantrine, the nationally-recommended artemisinin combination for the treatment of uncomplicated falciparum malaria, in southern Laos. Malaria Journal. 11(1): p. 184. 41.Mayxay M, Khanthavong M, Lindegardh N et al., (2004). Randomized comparison of chloroquine plus sulfadoxine-pyrimethamine versus artesunate plus mefloquine versus artemether-lumefantrine in the treatment of uncomplicated falciparum malaria in the Lao People's Democratic Republic. Clinical Infectious Diseases. 39(8): p. 1139:47. 42.42. Menan H, Faye O, Same-Ekobo A, Oga AS, Faye B et al., (2011). Comparative study of the efficacy and tolerability of dihydroartemisinin-piperaquine-trimethoprim versus artemether-lumefantrine in the treatment of uncomplicated Plasmodium falciparum malaria in Cameroon, Ivory Coast and Senegal. Malaria Journal 2011. 10: p. 185. 43.Mens PF, Sawa P, van Amsterdam SM, Versteeg I et al., (2008). A randomized trial to monitor the efficacy and effectiveness by QT-NASBA of artemether-lumefantrine versus dihydroartemisinin-piperaquine for treatment and transmission control of uncomplicated Plasmodium falciparum malaria in western Kenya. Malaria Journal. 7: p. 237. 44.Mwesigwa J, Parikh S, McGee B, German P et al., (2010). Pharmacokinetics of artemether-lumefantrine and artesunate-amodiaquine in children in Kampala, Uganda. Antimicrobial Agents and Chemotherapy. 54(1): p. 52:9. 45.Ndiaye JL, Faye B, Gueye A, Tine R, Ndiaye D et al., (2011). Repeated treatment of recurrent uncomplicated Plasmodium falciparum malaria in Senegal with fixed-dose artesunate plus amodiaquine versus fixed-dose artemether plus lumefantrine: a randomized, open-label trial. Malaria Journal 2011. 10: p. 237. 46.Ndiaye JL, Randrianarivelojosia M, Sagara I, Brasseur P, Ndiaye I, Faye B, et al., (2009). Randomized, multicentre assessment of the efficacy and safety of ASAQ: a fixed-dose artesunate-amodiaquine combination therapy in the treatment of uncomplicated Plasmodium falciparum malaria. Malaria Journal 2009. 8: p. 125. 47.Ngasala BE, Malmberg M, Carlsson AM, Ferreira PE et al., (2011). Effectiveness of artemether-lumefantrine provided by community health workers in under-five children with uncomplicated malaria in rural Tanzania: An open label prospective study. Malaria Journal. 10: p. 64. 48.Offianan A, Assis SB, Coulibaly A, N’guessan LT, Ako AA, Kadjo FK, et al., (2011). Assessment of the efficacy of first-line antimalarial drugs after 5 years of deployment by the National Malaria Control Programme in Côte d’Ivoire. Open Access Journal of Clinical Trials. 3: p. 67-76. 49.Piola P, Fogg C, Bajunirwe F, Biraro S, Grandesso F, Ruzagira E, et al.(2005). Supervised versus unsupervised intake of six-dose artemether-lumefantrine for treatment of acute, uncomplicated Plasmodium falciparum malaria in Mbarara, Uganda: a randomised trial. Lancet 2005. 365(9469): p. 1467:73. 50.Premji Z, Umeh RE, Owusu-Agyei S, Esamai F, Oguche S, et al., (2009). Chlorproguanil-dapsone-artesunate versus artemether-lumefantrine: A randomized, double-blind phase III trial in African children and adolescents with uncomplicated Plasmodium falciparum malaria. PLoS one 2009. 4(8): p. e6682. 51.Price RN, Uhlemann AC, van Vugt M, Brockman A et al., (2006). Molecular and pharmacological determinants of the therapeutic response to artemether-lumefantrine in multidrug-resistant Plasmodium falciparum malaria. Clinical Infectious Diseases. 42(11): p. 1570-7. 52.Bassat Q, Mulenga M, Tinto H, Piola P, Borrmann S, et al. (2009) Dihydroartemisinin-Piperaquine and Artemether-Lumefantrine for treating uncomplicated malaria in African children: A randomised, non-inferiority trial. PLoS one 4(11): e7871. doi:10.1371/journal.pone.0007871 53.Ratcliff A, Siswantoro H, Kenangalem E, Maristela R, Wuwung RM, Laihad F, et al. Two fixed-dose artemisinin combinations for drug-resistant falciparum and vivax malaria in Papua, Indonesia: an open-label randomised comparison. Lancet 2007. 369(9563): p. 757-65. 54.Sagara I, Diallo A, Kone M, Coulibaly M, Diawara SI et al., (2008). A randomized trial of artesunate-mefloquine versus artemether-lumefantrine for treatment of uncomplicated Plasmodium falciparum malaria in Mali. Americal Journal of Tropical Medicine Hygiene 2008. 79(5): p. 655-61. 55.Sawa P, Shekalaghe SA, DrakeleyCJ, Sutherland CJ, Mweresa CK, Baidjoe AY, et al. Malaria transmission after artemether-lumefantrine and dihydroartemisinin-piperaquine: A randomized trial. Journal of Infectious Diseases 2013. 207(11): p. 1637-45. 56.Smithuis F, Kyaw MK, Phe O, Win T, Aung PP, Oo AP, et al. Effectiveness of five artemisinin combination regimens with or without primaquine in uncomplicated falciparum malaria: an open-label randomised trial. Lancet Infectious Diseases 2010. 10(10): p. 673-81. 57.Sutherland CJ, Ord R, Dunyo S, Jawara M, Drakeley CJ, Alexander N, et al. Reduction of malaria transmission to Anopheles mosquitoes with a six-dose regimen of co-artemether. PLoS Medicine 2005. 2(4): p. e92. 58.The 4ABC Study Group (2011). A head-to-head comparison of four artemisinin-based combinations for treating uncomplicated malaria in African children: a randomized trial. PLoS Medicine;8(11):e1001119. 59.Toure OA, Kouame MG, Didier YJ, Berenger AA et al., (2011). Artesunate-mefloquine paediatric formulation vs. artemether-lumefantrine for the treatment of uncomplicated Plasmodium falciparum in Anonkoua koute, Cote d'Ivoire. Tropical Medicine and International Health 2011. 16(3): p. 290-7. 60.Toure OA, Penali LK, Yapi JD, Ako BA, Toure W, Djerea K, et al. A comparative, randomized clinical trial of artemisinin/ naphtoquine twice daily one day versus artemether/lumefantrine six doses regimen in children and adults with uncomplicated falciparum malaria in Cote d'Ivoire. Malaria Journal 2009. 8: p. 148. 61.Ursing J, Kofoed PE, Rodrigues A, Blessborn D, Thoft-Nielsen R, Bjorkman A, et al., (2011). Similar efficacy and tolerability of double-dose chloroquine and artemether-lumefantrine for treatment of Plasmodium falciparum infection in Guinea-Bissau: A randomized trial. Journal Infectious Diseases. 203(1): p. 109-16. 62.Van den Broek I, Kitz C, Al Attas S, Libama F et al., (2006). Efficacy of three artemisinin combination therapies for the treatment of uncomplicated Plasmodium falciparum malaria in the Republic of Congo. Malaria Journal 2006. 5: p. 113. 63.Van den Broek I, Maung UA, Peters A, Liem L et al., (2005). Efficacy of chloroquine+sulfadoxine-pyrimethamine, mefloquine + artesunate and artemether + lumefantrine combination therapies to treat Plasmodium falciparum malaria in the Chittagong Hill Tracts, Bangladesh. Transactions of the Royal Society of Tropical Medicine and Hygiene. 99(10): p. 727-35. 64.Van Vugt M, Looareesuwan S, Wilairatana P, McGready R, Villegas L, Gathmann I et al. Artemether-lumefantrine for the treatment of multidrug-resistant falciparum malaria. Transactions of the Royal Society of Tropical Medicine and Hygiene 2000. 94(5): p. 545-8. 65.Van Vugt MV, Wilairatana P, Gemperli B, Gathmann I, Phaipun L, Brockman A, et al (1999). Efficacy of six doses of artemether-lumefantrine (benflumetol) in multidrug-resistant Plasmodium falciparum malaria. American Journal of Tropical Medicine and Hygiene 1999. 60(6): p. 936-42. 66.W, Faye B, Kuete T, Djohan V, Oga SA, Kassi RR, et al., (2011). Multicentric assessment of the efficacy and tolerability of dihydroartemisinin-piperaquine compared to artemether-lumefantrine in the treatment of uncomplicated Plasmodium falciparum malaria in sub-Saharan Africa. Malaria Journal 2011. 10: p. 198. 67.Yeka A, Dorsey G, Kamya MR, Talisuna A, Lugemwa M et al.(2008). Artemether-lumefantrine versus dihydroartemisinin-iperaquine for treating uncomplicated malaria: a randomized trial to guide policy in Uganda. PLoS one 2008. 3(6): p. e2390. 68.Yeka A, Tibenderana J, Achan J, D'Alessandro U and Talisuna AO. Efficacy of quinine, artemether-umefantrine nd dihydroartemisinin-iperaquine as rescue treatment for uncomplicated malaria in Ugandan children. PloS one 2013. 8(1): p. e53772. 69.Zongo I, Dorsey G, Rouamba N, Dokomajilar C et al., (2007). Randomized comparison of modiaquine plus sulfadoxine-pyrimethamine, artemether-lumefantrine, and dihydroartemisinin-iperaquine or the treatment of uncomplicated Plasmodium falciparum malaria in Burkina Faso. Clinical Infectious Diseases 2007. 45(11): p. 1453-61. 70.Zongo I, Dorsey G, Rouamba N, Tinto H, Dokomajilar C et al., (2007). Artemether-umefantrine versus modiaquine plus sulfadoxine-pyrimethamine for uncomplicated falciparum malaria in Burkina Faso: A randomised non-inferiority trial. Lancet. 369(9560): p. 491-8. 71.WHO release (2013). WHO Alert on Counterfeit Coartem, 08 November 2013. 72.Coartem [Prescribing Information], Novartis Pharmaceuticals Corporation, East Hanover, NJ. 2010.
|

