|
Vai trò của Fibroscan® và Fibrotest® trong chẩn đoán và theo dõi điều trị viêm gan và xơ gan
Xơ gan (cirrhosis) là một tình trạng mà trong đó gan không đảm nhận chức năng đầy đủ do mọt quá trình thương tổn lâu dài, điển hình là bệnh diễn tiến chậm sau nhiều năm và những thời gian đầu thường không có triệu chứng. Vì tình trạng bệnh có thể nghiêm trọng và diễn tiến xấu dần và khi đó bệnh nhân hay mệt, yếu người, ngứa, sưng phù chi dưới, vàng da, vết thâm tím dễ dàng xảy ra và cs dịch ổ bụng, hoặc có nốt nhện trên da. Các biến chứng khác có thể gồm có bệnh lý não gan, xuất huyết do tĩnh mạch trướng thực quản hoặc tĩnh mạch dạ dày và ung thư gan. Cuối cùng bệnh lý não gan sẽ đưa đến lũ lẫn, mất ý thức và hôn mê gan. Xơ gan có thể do quá trình bệnh lý trước đó như nghiên rượu, viêm gan siêu vi B, viêm gan siêu vi C và gan nhiễm mỡ không do rượu. Các bệnh lý gan nhiễm mỡ không do rượu là do nhiều nguyên nhân, như béo phì, tiểu đường, mỡ máu cao và cao huyết cao. Một số nguyên nhân ít gặp hơn như viêm gan miễn dịch, xơ gan mật tiên phát, nhiễm sắt trong nhu mô gan, do thuốc,..Xơ gan còn đặc trưng bởi hình ảnh thay thế mô gan bình thường thành các mô sẹo. Các thay đổi như thế làm mất đi chức năng gan. Chẩn đoán dựa trên xét nghiệm máu, chẩn đoán hình ảnh và sinh thiết gan. Xơ gan là tình trạng bệnh phổ biến ở Việt Nam và trên thế giới. Theo thống kê của Hội gan mật Việt Nam (2006): 15% dân số bị viêm gan B mạn tính, 6% viêm gan C mạn tính. Đã có nhiều sự tiến bộ của y học trong điều trị bệnh nhưng vẫn có 50% xơ gan rượu và 75% xơ gan do viêm gan virut tử vong sau 5 năm phát hiện bệnh. Thực tế này cho thấy tầm quan trọng của lâm sàng trong việc đánh giá tình trạng xơ hóa gan và phát hiện xơ gan ở giai đoạn còn bù. Từ lâu nay, sinh thiết gan được xem như là “chuẩn vàng” để chẩn đoán xác định mức độ và giai đoạn của xơ gan, nhưng đây là một kỹ thuật phức tạp và có những tai biến nhất định có thể ảnh hưởng đến tính mạng người bệnh. Chính vì vậy đã có hàng loạt các phương pháp không xâm lấn ra đời nhằm đánh giá mức độ xơ hóa gan, trong đó có kỹ thuật FibroScan để đo độ đàn hồi/ độ cứng của gan. Thế giới đã có nhiều công trình ứng dụng FibroScan trong chẩn đoán và tiên lượng biến chứng của xơ gan, không để lại bất kỳ tai biến nào, có khả năng lặp đi lặp lại nhiều lần mà các phương pháp khác không thể có được. 1. FibroScan® là gì và những ứng dụng của nó như thế nào trong lâm sàng?Xét nghiệm với FibroScan® còn được gọi là đánh giá độ đàn hồi thoáng qua (“transient elastography”) là một kỹ thuật được sử dụng đánh giá độ cứng của nhu mô gan (liver stiffness) đo bằng kPa liên quan đến xơ hóa mà không cần phải có thủ thuật xâm lấn. Kết quả quả ngay, nó cho thấy tình trạng của gan và cho phép các thầy thuốc chẩn đoán và theo dõi tiến triển của bệnh cùng với tiến trình điều trị và các yếu tố bổ sung khác. Fibroscan Kỹ thuật mới trong tầm soát và chẩn đoán xơ ganNgoài sinh thiết gan được xem là tiêu chuẩn vàng để chẩn đoán xác định mức độ và giai đoạn của xơ gan, hiện nay FibroScan là một kỹ thuật mới có hiệu quả cao trong việc tầm soát và chẩn đoán bệnh. Xơ gan là một bệnh nguy hiểm, đứng thứ 12 trong số các nguyên nhân gây tử vong trên thế giới (theo thống kê của Hội Ung thư Mỹ - American Liver Foundation). Những người có nguy cơ mắc bệnh xơ gan cao là: bệnh nhân bị viêm gan mãn tính (viêm gan B và C…), rối loạn mỡ máu, tiểu đường… Ngoài ra, nguy cơ xơ gan ở những người uống nhiều bia rượu hay trong gia đình có người thân bị bệnh gan cũng cao hơn. Điều đáng ngại là bệnh không có triệu chứng rõ ràng giai đoạn đầu nhưng khi tiến triển nặng thành ung thư gan, suy gan… lại gây ra các biến chứng nguy hiểm và tử vong. Máy tầm soát và chẩn đoán mức độ xơ gan Fibroscan là thiết bị duy nhất trên thế giới hiện nay giúp tầm soát và xác định mức độ xơ hóa trong gan không gây đau, hoàn toàn không ảnh hưởng đến sức khỏe. Các kết quả kiểm tra sẽ giúp chúng ta tiên đoán và dè chừng các biến chứng khác nhau, cũng như giám sát và đánh giá tổn thương gan gây ra bởi quá trình xơ hóa. Xét nghiệm kiểm tra FibroScan® dễ thực hiện, không đau và cho kết quả nhanh chóng. Trong suốt quá trình thao tác, đo lường, bệnh nhân chỉ cảm thấy rung nhẹ trên da ở vị trí mà đầu dò di chuyển đến. Những thông số nào cho biết khi thực hiện FibroScan®? ·Bạn nằm ngửa, tay phải của bạn đặt sau đầu, thầy thuốc thực hiên sẽ dùng mọt chất gel thoa trên da của bạn và đặt đầu dòi lên trên đó và ấn với mọt áp lực nhẹ; ·Kiểm tra khảo sát gồm 10 phép đo liên tục tại cùng một vị trí; ·Kết quả được phân tích vào thời điểm cuối cùng của cuộc khảo sát, đó là một con số có thể dao động thay đổi từ 1.5 - 75 kPa. Bác sĩ của bạn sẽ phiên giải kết quả đó; ·Thầy thuốc sẽ phiên giải kết quả theo tiền sử bệnh và bệnh lý nền sẵn có của bạn; ·Thầy thuốc chuyên khoa gan hoặc bác sĩ điều trị cho bạn được chỉ định cho bạn làm xét nghiệm FibroScan® vào thời điểm thích hợp nhất; ·Kết quả của thử nghiệm Fibroscan® cho ngay sau 5-10 phút và là một thủ thuật cận lâm sàng không xâm lấn và không đau; ·Nếu cần thiết kiểm tra lại thử nghiệm vẫn có thể lặp lại mà không ảnh hưởng gì vì đây là một thủ thuật an toàn. Ở Việt Nam, FibroScan là thiết bị mới được đưa vào áp dụng thời gian 5 năm trở lại, nên một số nghiên cứu đa trung tâm tiến hành nhằm tìm hiểu chỉ số FibroScan trong xơ gan. Đánh giá sự thay đổi của chỉ số FibroScan với mức độ nặng nhẹ của xơ gan theo phân loại Child-Pugh. Nghiên cứu trên đối tượng bệnh nhân điều trị nội trú hoặc ngoại trú tại BV Bạch Mai và BV Đại học Y Hà Nội trong thời gian từ năm 2007-2010. Bệnh nhân được phân ra làm 2 nhóm: nhóm xơ gan, nhóm chứng, tương đồng về cân nặng, và tuổi hơn kém nhau không quá 5 năm. ·Tiêu chuẩn chẩn đoán xác định xơ gan khi bệnh nhân đáp ứng 1 trong các tiêu chuẩn sau: -Bệnh nhân có đầy đủ 2 hội chứng suy tế bào gan và hội chứng tăng áp lực tĩnh mạch cửa; -Bệnh nhân có hội chứng suy tế bào gan và tĩnh mạch cửa > 13 mm (qua siêu âm bụng), soi dạ dày có giãn tĩnh mạch thực quản và/ hoặc giãn tĩnh mạch phình vị; -Bệnh nhân có hội chứng tăng áp lực tĩnh mạch cửa và albumin máu giảm, bilirubine máu tăng, tỷ prothrombin giảm; -Soi ổ bụng có hình ảnh xơ gan; Mô bệnh học (qua sinh thiết gan) có xơ gan. ·Xếp loai mức độ nặng xơ gan theo tiêu chuẩn Child-Pugh (1991): ·Tiêu chuẩn loại trừ: bệnh nhân béo phì BMI > 25, lớp mỡ dưới da quá dày, khoang liên sườn quá hẹp; Dịch cổ trướng quá nhiều; Kết quả Fibroscan không được chấp nhận; ·Nhóm chứng gồm những người đi kiểm tra chức năng gan, có hình ảnh siêu âm gan và men gan ALT bình thường, đồng ý làm siêu âm FibroScan. Với phương pháp tiến cứu, mô tả, thiết bị được sử dụng để đo độ cứng của gan là máy siêu âm FibroScan do hãng Echosens (Pháp) chế tạo, đặt tại khoa khám chữa bệnh theo yêu cầu bệnh viện Bạch Mai: bệnh nhân ở tư thế nằm ngửa với cánh tay phải dạng ra hết mức và lòng bàn tay để sau gáy, thủ thuật được tiến hành ít nhất 2 giờ sau khi ăn. Đầu dò FibroScan vuông góc với bề mặt da vào khoang liên sườn của bệnh nhân tương ứng với thùy (P) của gan. Mỗi bệnh nhân phải có 10 giá trị đo thành công trong quá trình thăm khám. Kết quả cuối cùng được xác định sau khoảng 5 phút, thể hiện bằng đơn vị định lượng kPa qua màn hình giao diện người dùng. Sinh thiết gan qua da bằng súng ProMag hoặc sinh thiết gan mù bằng kim Menghini. Mảnh sinh thiết tối thiểu phải đủ dài 1,5 cm để đảm bảo lấy đươc ít nhất 4 khoảng cửa. Xử lý và phân tích số liệu trên máy tính bằng phần mềm SPSS 15.0 và phần mềm thống kê y học Medcalc 9.6.2.0. ·Kết quả cho thấy: -Trên các bệnh nhân xơ gan, chỉ số FibroScan: 35,35 kPa; -Trên nhóm chứng: chỉ số Fibroscan: 5,29 kPa. -Ngưỡng chẩn đoán xơ gan là 18,5 kPa với độ nhạy (Se) 100%, độ đặc hiệu (Sp) 47,2%, giá trị dự kiến dương tính (PPV) 19,1%, Giá trị dự kiến ấn tính (NPV) là 100%; -AU-ROC là -0,917. Với diện tích dưới đường cong AUROC > 0,7, ngưỡng chẩn đoán giãn tĩnh mạch thực quản 2- 3, xơ gan Child C, cổ trướng và xuất huyết tiêu hóa lần lượt là 27,7 kPa, 43,9 kPa, 43,5 kPa, 58,2 kPa; -Chỉ số FibroScan tăng theo mức độ nặng của xơ gan và có liên quan chặt chẽ với điểm Child Pugh với r = 0,65. Kết luận rằng FibroScan là một thủ thuật hứa hẹn trong chẩn đoán xơ gan và phát hiện sớm các biến chứng của xơ gan. Một nghiên cứu thứ hai liên quan nghiên cứu chỉ số fibroscan và fibrotest trong đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan C mạn tính ghi nhận viêm gan do virus viêm gan C là một bệnh phổ biến trên thế giới và tại Việt Nam. Theo Tổ chức Y tế thế giới (TCYTTG), hiện nay có khoảng 130-210 triệu người trên thế giới nhiễm HCV (khoảng 3% dân số). Tỷ lệ này thay đổi tùy khu vực địa lý, cao nhất ở Ai Cập là 9%, ở Tây Âu là 0,4-3%. Tại Mỹ, mỗi năm có khoảng 3,9 triệu người (chiếm 1,2% dân số) nhiễm HCV và có 8.000-10.000 người chết do các biến chứng liên quan đến HCV. Viêm gan do virus viêm gan C diễn biến âm thầm, ít khi có triệu chứng, chủ yếu phát hiện tình cờ khi xét nghiệm máu hoặc có biểu hiện ở giai đoạn muộn đặc biệt là xơ gan (10-40% bệnh nhân VGC mạn tính tiến triển xơ gan). Các giai đoạn của xơ gan rất quan trọng trong việc quản lý, điều trị và tiên lượng bệnh viêm gan C mạn tính. Phân loại mức độ xơ hóa của gan (theo Metavir) là công cụ hữu ích để phục vụ cho mục đích này. Trên thế giới có nhiều phương pháp đánh giá mức độ xơ hóa của gan trong đó sinh thiết gan được coi là “chuẩn vàng”. Tuy nhiên, sinh thiết gan là thủ thuật xâm lấn có thể gây biến chứng nguy hiểm (chảy máu, nhiễm trùng, thậm chí có thể tử vong) và có hạn chế về lỗi lấy mẫu, chủ quan người đọc kết quả. Do đó, sinh thiết gan ít được tiến hành nhiều lần và tỷ lệ bệnh nhân từ chối cao. Một số phương pháp không xâm nhập để đánh giá mức độ xơ hóa của gan được khuyến khích và phát triển như: chỉ số FibroScan, FibroTest, APRI, FibroMettre, HepaScore, Forns. Trong đó Fibroscan, Fibro Test là các phương pháp có thể thực hiện nhiều lần và đem lại hiệu quả cao. FibroScan sử dụng sóng siêu âm và sóng đàn hồi tần số thấp để đo độ cứng của gan. Tùy theo độ cứng của gan đo được sẽ tương ứng với mức độ xơ hóa của gan theo thang điểm Metavir. Các ngưỡng giá trị tương ứng với từng giai đoạn xơ hóa (F0, F1, F2, F3, F4) đã được nhiều nghiên cứu trên thế giới nêu ra với độ tin cậy rất cao. FibroTest là sự kết hợp của 5 thông số trong huyết thanh không liên quan đến bữa ăn: γ-glutamyl transpeptidase, bilirubin toàn phần, α2 - macroglobulin, apolipoprotein A1 và haptoglobin để đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan mạn tính với độ nhạy và độ đặc hiệu lần lượt là 75%, 85%. FibroTest được công nhận và đề nghị là xét nghiệm thay thế cho sinh thiết gan ở bệnh nhân viêm gan C mạn tính. Ở Việt Nam chưa có nhiều công trình nghiên cứu về FibroScan và đặc biệt FibroTest rất ít. Do vậy, tiến hành nghiên cứu đề tài: “Nghiên cứu chỉ số Fibroscan và FibroTest trong đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan C mạn tính” với hai mục tiêu sau: (i) Nghiên cứu chỉ số FibroScan, FibroTest trong đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan C mạn tính; (ii) Nhận xét ưu và nhược điểm của chỉ số Fibroscan, FibroTest trong đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan C mạn tính. Năm 1974 Feinstone và Prince đã phát hiện những trường hợp viêm gan sau truyền máu không phải viêm gan A hoặc viêm gan B được gọi là viêm gan non A - non B (NANB). Trong giai đoạn này chẩn đoán viêm gan NANB là một chẩn đoán loại trừ. Giữa năm 1980 nhiều nghiên cứu virus NANB nhận thấy vius gây NANB là một Retrovirus, có enzyme sao chép ngược. Đến tháng 9.1982, Perroni P và cộng sự đã báo cáo tại hội nghị Gan mật châu Âu (Thụy Điển) phương pháp phát hiện NANB bằng miễn dịch phóng xạ, dùng kháng nguyên lấy từ máu bệnh nhân về lâm sàng được khẳng định là viêm gan cấp NANB. Đến năm 1989 nhờ phương pháp tạo dòng vô tính và phân tích trình tự bộ gen virus, Choo và cộng sự lần đầu tiên phát hiện virus viêm gan C (HCV). Năm 1991, HCV được xếp vào loại Flaviviridae. Năm 1995 HCV mới được quan sát dưới kính hiển vi điện tử. Dịch tễ học viêm gan C:Theo tổ chức Y tế thế giới, hiện nay có khoảng 210 triệu người (3% dân số) trên thế giới nhiễm HCV và mỗi năm có thêm 3-4 triệu người mới nhiễm. Tỷ lệ nhiễm HCV trên thế giới khác nhau, tùy theo từng quốc gia và phụ thuộc nhiều yếu tố như điều kiện kinh tế, xã hội, y tế, chủng tộc. Viêm gan C là một vấn đề lớn trong sức khỏe cộng đồng, có ba khu vực được phân chia dựa vào anti HCV.+ Vùng có tỷ lệ thấp dưới 0,5-1% như các nước Đan Mạch, Úc, Thụy Sỹ, Canada;+ Vùng nhiễm vừa với tỷ lệ 0,5-1%;+ Vùng có tỷ lệ nhiễm cao trên 1% như Pháp là 1,2%, trong đó 80% có dấu hiệu HCV đang nhân lên (HCV-RNA dương tính) và người mang HCV mạn tính là 0,1%. Ở Mỹ tỷ lệ nhiễm HCV là 1,8%, những người có nhiều bạn tình cao gấp 23 lần người chưa hoặc chỉ có một bạn tình (9% so với 0,4%) và cao hơn nữa ở người nghiện chích ma túy (13% so với 1%). Các nước vùng Đông Âu, Nhật Bản và nhiều nước đang phát triển khác trong đó có châu Á có tỷ lệ nhiễm cao nhất có thể tới 5%. Tại Việt Nam, cho đến nay việc nghiên cứu dịch tễ học nhiễm HCV còn rất hạn chế. Tỷ lệ nhiễm HCV cao thường tập trung ở những đối tượng có nguy cơ cao như người mắc bệnh ưa chảy máu, người nghiện chích ma túy, bệnh nhân lọc máu. Theo Nguyễn Thu Vân, Hoàng Thủy Nguyên, Phạm Song, Đào Đình Đức tỷ lệ nhiễm HCV trong cộng đồng dân cư nước ta là 0,4-1,35%. Tỷ lệ có anti HCV (+) tại Hà Nội khoảng 4% ở các nhân viên y tế và phụ nữ mang thai. Tỷ lệ nhiễm HCV cao hơn nhiều ở người mắc bệnh ưa chảy máu là 6%, đặc biệt rất cao ở những người nghiện chích ma túy 31%, ở những người cho máu tỷ lệ đó thấp hơn 0,8%. Nghiên cứu của Trần Thanh Dương trên các nhóm đối tượng tại Hà Nội năm 2004, tỷ lệ anti-HCV (+) ở nhóm người bình thường là 1,34%, nhóm người nghiện chích ma túy là 70,17%, nhóm gái mại dâm là 20,59%, bệnh nhân chạy thận nhân tạo và truyền máu nhiều lần là 63,59%, cán bộ y tế 3,57%.Nghiên cứu của Trịnh Thị Ngọc (2001) cho thấy tỉ lệ HCV chiếm 3,1% trong viêm gan cấp, 4,4% trong viêm gan mạn, 4,3% trong xơ gan, ngoài ra nhiễm HCV còn gặp ở những bệnh nhân đồng nhiễm viêm gan virus, HIV. Tại thành phố Hồ Chí Minh, nhiễm HCV trong quần thể bình thường là 3,2 - 4,2%, tỷ lệ này trội ở những bệnh nhân ưa chảy máu là 29%, đặc biệt ở những người nghiện chích ma túy là 87 - 96,9%, tỷ lệ ở những người cho máu là 20,6%. Triệu chứng lâm sàng viêm gan và xét nghiệm VGC: bệnh cảnh lâm sàng của viêm gan C rất đa dạng từ thể nhẹ không có triệu chứng à cấp tính à tối cấp à mạn tính đến xơ gan và ung thư gan. Thời kì ủ bệnh dao động từ 30 - 120 ngày, trung bình 50 ngày. Viêm gan C cấp, sau khi nhiễm HCV, phần lớn 75% không có biểu hiện lâm sàng, 40-60% có nồng độ ALT bình thường mặc dù có HCV- RNA cao, nhưng tổn thương gan là 80%, vàng da gặp khoảng 10%. Viêm gan cấp với ALT tăng gấp 2,5 lần mức bình thường, 25% bệnh nhân có triệu chứng vàng da, rối loạn tiêu hóa thường không rõ. Ở bệnh nhân viêm gan C cấp HCV-ARN xuất hiện sớm trước khi có biểu hiện lâm sàng 1-2 tuần và nồng độ lên đạt đỉnh số bản sao sau vài tuần. Các kháng thể anti-HCV xuất hiện muộn sau khi có tăng ALT và biểu hiện lâm sàng. Trong các trường hợp nhiễm HCV chỉ có 30-50% được phát hiện trong những tháng đầu, 80% được phát hiện sau 15 tuần. Kết quả này cho thấy nhiều trường hợp nhiễm HCV không được phát hiện.Viêm gan C mạn tính: triệu chứng cơ năng và toàn thân của viêm gan C mạn tính cũng tương tự như các viêm gan do virus khác, triệu chứng không đặc hiệu (mệt mỏi, ăn uống kém, gầy sút cân, chậm tiêu, sốt nhẹ, rối loạn tiêu hóa. Những triệu chứng này thường được bỏ qua hay chẩn đoán là một bệnh khác. Đôi khi bệnh nhân thấy đau tức vùng hạ sườn (P), khi thăm khám không phát hiện được gan lách to thường không có phù hoặc cổ trướng. Chỉ khi bệnh nặng hoặc có biến chứng xơ gan mới xuất hiện các triệu chứng này. Do vậy, viêm gan C mạn tính cần được chẩn đoán sớm. Bên cạnh những triệu chứng không đặc hiệu trên, cần phải chú ý đến triệu chứng ngoài gan đặc biệt đối với viêm gan virus C mạn, ít khi biểu hiện tại chỗ nhưng có thể có biểu hiện ở khớp và thận như đau khớp, viêm cầu thận, viêm đa dây thần kinh. Đau khớp có tính chất đối xứng, ít khi sưng đau nhiều khớp, tái phát nhiều lần nhưng không để lại di chứng, không làm biến dạng khớp. Những thay đổi ngoài da: da xạm, khô, sao mạch, giãn mạch, trứng cá, mày đay cũng cần chú ý. Bệnh tuyến giáp và một số bệnh tự miễn khác (viêm loét đại trực tràng chảy máu, viêm khớp dạng thấp…có thể gặp ở những bệnh nhân này. Chú ý khai thác tiền sử bệnh gan di truyền có trước của bản thân và gia đình người bệnh. ·Xét nghiệm trong chẩn đoán VGC gồm có: -XN đánh giá hủy hoại tế bào gan như thông số AST, ALT. Trong đó, ALT đặc trưng cho gan;-XN đánh giá chức năng gan: protein toàn phần, albunin, bilirubin, tỷ lệ prothrombin. Khi chức năng gan suy giảm, các chỉ số protein toàn phần, albumin, tỷ lệ prothrombin sẽ giảm dưới giá trị bình thường;-XN đánh giá mức độ vàng da, bilirubin toàn phần bình thường < 17 micromol/L, triệu chứng vàng da xuất hiện khi bilirubin toàn phần tăng trên giá trị bình thường. Trong viêm gan do virus, bilirubin toàn phần và bilirubin trực tiếp tăng;-Chẩn đoán nhiễm HCV nên chú trọng ở những bệnh nhân có nguy cơ cao, các bệnh nhân có triệu chứng viêm gan sau truyền máu và các sản phẩm của máu, bệnh nhân chạy thận nhân tạo, bệnh nhân có tiền sử tiêm chích ma túy, quan hệ tình dục với người nghi mắc bệnh hoặc phơi nhiễm bơm kim tiêm với người có anti-HCV (+), sau khi đã loại trừ các loại viêm gan khác như A, B, D, Cytomegalovirus (CMV), hay Epstein Barr virus (EBV). -Chẩn đoán viêm gan C, sớm nhất là kỹ thuật huyết thanh học. Việc nghiên cứu các kỹ thuật huyết thanh học được thực hiện từ năm 1989, ngay khi HCV được phát hiện và được triển khai một số nước từ năm 1990. Chẩn đoán huyết thanh học là phương pháp dùng các kháng nguyên mẫu để phát hiện các kháng thể đặc hiệu trong huyết thanh. Kháng thể anti-HCV xuất hiện muộn trong nhiễm virus viêm gan C, đây là loại kháng thể không bảo vệ. Trong những tháng đầu chỉ có 30-50% các trường hợp phát hiện anti HCV. Sau 6 tháng có 80% các trường hợp phát hiện anti-HCV và tồn tại nhiều tháng. Kháng thể anti-HCV có thể tìm thấy trong giai đoạn đang tiến triển hoặc nhiễm trùng đã khỏi không còn mang virus. Các kỹ thuật chẩn đoán huyết thanh phát triển rất nhanh. Ngày nay với sự phát triển của công nghệ sinh học phân tử như PCR phát hiện HCV-ARN đã góp phần chẩn đoán sớm và theo dõi điều trị viêm gan C có hiệu quả.Hiện nay các phòng xét nghiệm thường sử dụng hai XN để phát hiện kháng thể anti-HCV:+ Thử nghiệm phát hiện kháng thể kháng virus viêm gan C (anti-HCV): xét nghiệm ELISA hay thử nghiệm miễn dịch gắn men;+ Thử nghiệm khẳng định là XN miễn dịch vạch (Recombinant Immuno-Blot Assay_RIBA).-Phát hiện HCV-ARN, có 2 kỹ thuật chính+ PCR: xác định RNA, độ nhạy và độ khuếch đại rất lớn. Real time-PCR định lượng HCV-ARN độ nhạy và độ đặc hiệu cao;+ Phương pháp DNA nhánh hóa (bDNA) định lượng HCV-ARN có độ nhạy và độ đặc hiệu kém PCR;-Kỹ thuật định genotyp: nhiều phương pháp EISA, Real time-PCR, phương pháp lai.·Mô bệnh học của viêm C gan mạn tính: viêm gan C mạn tính có 2 thể dựa vào:-Viêm gan mạn tính thể ổn định: + Tổn thương chủ yếu là ở khoảng cửa, xâm nhập tế bào viêm loại một nhân, tổ chức xơ phát triển rất ít;+ Hoại tử tế bào gan rất ít, không có hoại tử tế bào kiểu mối gặm;+ Thoái hóa tế bào gan: có thể có;+ Tiểu thùy gan hoàn toàn bình thường, ranh giới tiểu thùy không bị phá hủy. -Viêm gan mạn tính tiến triển:+ Tổn thương cũng xuất phát từ khoảng cửa: xâm nhập tế bào viêm loại một nhân vào khoảng cửa và tiểu thùy. Tổ chức xơ phát triển vào khoảng cửa và xung quanh khoảng cửa, xâm nhập vào cả trong tiểu thùy;+ Đặc biệt có hoại tử tế bào gan, đặc biệt có nhiều hình thái hoại tử tế bào gan khác nhau:.Hoại tử vùng rìa tiểu thùy (hoại tử mối gặm);.Hoại tử vùng cạnh khoảng cửa;.Hoại tử kiểu cầu nối;.Hoại tử kiểu hoa hồng;.Hoại tử khối: cả tiểu thùy hoặc phần lớn tiểu thùy bị hoại tử.+ Tế bào gan còn loại bị thoái hóa: tế bào bị phù nề, mạng lưới nội sinh chất nở to, có một số tế bào gan đặc bắt màu acid, có khi chuyển thành thể coucimal, đó là đám các tế bào hoại tử bị kết lại;+ Đường mật có thể bị tổn thương: hoại tử và tái sinh, trường hợp này cần chẩn đoán với xơ gan mật tiên phát;+ Cần phân biệt với viêm gan cấp, trong viêm gan cấp thì hoại tử ở trung tâm tiểu thùy, còn viêm gan mạn thì hoại tử ở vùng xung quanh tiểu thùy. Nếu thời gian kéo dài quá 6 tháng mà tổn thương vẫn giống như viêm gan cấp thì được xếp loại viêm gan mạn (gọi là viêm gan mạn tiểu thùy).+ Trong viêm gan mạn tiến triển, các tổn thương phá vỡ ranh giới của tiểu thùy, xâm nhập vào trong tiểu thùy (khác với viêm gan mạn ổn định) nhưng không làm đảo lộn cấu trúc của tiểu thùy, không có nhân tái sinh (khác với xơ gan).-Viêm gan mạn tính có 5 giai đoạn xơ hóa và 4 giai đoạn mức độ hoạt động theo Metavir:5 giai đoạn xơ hóa:+ F0: Không có xơ hóa;+ F1: Xơ hóa khoảng cửa nhưng không có vách ngăn;+ F2: Xơ hóa khoảng cửa và có vài vách ngăn mở rộng đến tiểu thùy;+ F3: Xơ hóa khoảng cửa và có nhiều vách ngăn nhưng không có xơ gan;+ F4: Xơ gan.4 mức độ hoạt động:+ A0: Không có hoạt động mô học. Không có hoại tử;+ A1: Hoạt động nhẹ khi:.Hoặc hoại tử mối gặm không có, hoặc hoại tử tiểu thùy vừa;.Hoặc hoại tử mối gặm nhẹ, hoại tử tiểu thùy không có, nhẹ hoặc vừa.+ A2: Hoạt động vừa khi:. Hoặc hoại tử mối gặm không có, hoại tử tiểu thùy nặng;. Hoặc hoại tử mối gặm nhẹ, hoại tử tiểu thùy nặng.. Hoặc hoại tử mối gặm vừa, hoại tử tiểu thùy không có, nhẹ hoặc vừa.+ A3: Hoạt động nặng khi:. Hoặc hoại tử mối gặm vừa, hoại tử tiểu thùy nặng.. Hoặc hoại tử mối gặm nặng, hoại tử tiểu thùy không có, nhẹ, vừa, hoặc nặng.Tiến triển virus viêm gan C-Viêm gan C mạn được xác định bằng các phản ứng viêm xảy ra tại gan kéo dài, với ALT cao trên 6 tháng. Nhiễm HCV đặc biệt nguy hại do tần suất chuyển sang mạn tính rất cao 80-85%. Theo một nghiên cứu ở Nhật Bản, 81,1% viêm gan cấp sẽ phát triển thành viêm gan mạn. Nhiễm HCV kéo dài hàng chục năm, men gan tăng giảm không phụ thuộc vào triệu chứng lâm sàng, nồng độ HCV-ARN duy trì ổn định trong huyết thanh. -Khoảng 20-30% viêm gan mạn tiến triển sau một thời gian có thể phát triển thành xơ gan, 30% những người viêm gan mạn có nguy cơ đưa đến ung thư gan tiên phát sau 10-20 năm;-Nhiễm HCV và ung thư gan: trên thế giới 52,3% số bệnh nhân ung thư gan có liên quan với nhiễm HBV, 25% với HCV. Ở Việt Nam khoảng 81% có liên quan với HBV và khoảng 13,7-15,8% liên quan với HCV . Ở châu Âu khi ứng dụng PCR vào xét nghiệm để chẩn đoán người ta thấy HCV-ARN dương tính ở 7% trong huyết thanh, 0,26% trong nhu mô gan ở bệnh nhân ung thư biểu mô tế bào gan có anti-HCV âm tính. ·Điều trị và cách phòng bệnh-Điều trị:+ Tiêu chuẩn lựa chọn bệnh nhân điều trị là bệnh nhân được chẩn đoán xác định HCV (anti-HCV dương tính, HCV-ARN dương tính), tình trạng bệnh lý gan cấp hoặc mạn tính (men gan ALT tăng), có xơ gan hay không. + Đánh giá hiệu quả điều trị: bệnh nhân phải được làm xét nghiệm ALT kiểm tra hàng tháng, có hiệu quả khi các men này trở về bình thường, HCV-ARN âm tính. Nên kiểm tra trước, sau 3 tháng, 12 tháng và 18 tháng sau điều trị.- Dự phòng viêm gan virus CHiều biết các con đường lây nhiễm HIV giúp ta phòng nhiễm bệnh VGC tốt;
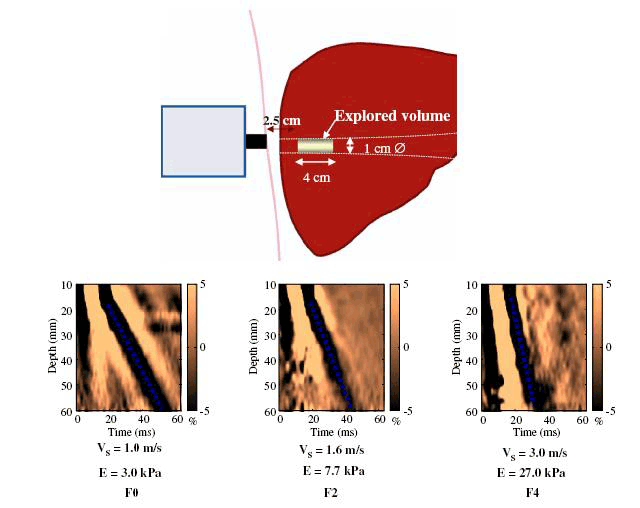
-Các con đường lây nhiễm HCV: Lây nhiễm theo đường máu, HCV chủ yếu lây qua đường máu, nhất là sau truyền máu hoặc các phương tiện tiếp xúc với máu như kim bơm tiêm, thẩm phân máu đặc biệt ở những bệnh nhân chạy thận nhân tạo, tỉ lệ nhiễm HCV cao 20%, tiêm chích ma túy 71,73%. Sâu lỗ tai, xăm mình dùng dụng cụ không vô trùng tốt có thể lây truyền HCV, nguy cơ lây truyền HCV khi phơi nhiễm bơm kim tiêm của bệnh nhân anti-HCV (+) khoảng 5-10%. Lây truyền từ mẹ sang con: tỉ lệ là 3-5% trong số những bà mẹ có anti-HCV (+), theo OhtoH những bà mẹ có nồng độ HCV-ARN > 106 bản sao/ml tỉ lệ truyền HCV cho cao hơn bà mẹ có nồng độ HCV-ARN < 106 bản sao/ml, tỉ lệ truyền cho con tăng lên khi mẹ đồng nhiễm với HIV;-Lây truyền qua đường tình dục: ít khoảng 5%, thấp hơn so HBV, tỷ lệ lâynhiễm tăng ở bệnh nhân đồng tính luyến ái hay người có nhiều bạn tình. Không rõ nguồn lây nhiễm: 20-30%;-Không có biện pháp dự phòng đặc hiệu đối với HCV, khi phát hiện được viêm gan C cấp, điều trị INF-anpha cũng là một biện pháp cần thiết dự phòng viêm gan C trở thành mạn tính; -Dự phòng không đặc hiệu như biện pháp phòng nhiễm HBV và HIV:+ Sàng lọc anti-HCV ở những người cho máu và đối tượng có nguy cơ cao;+ Hạn chế truyền máu tới mức cần thiết, tốt nhất dùng máu tự thân+ Thực hiện tốt các biện pháp khử trùng, tiệt trùng, trong y tế;+ Chống tệ nạn ma túy, mại dâm, giáo dục người nghiện dùng bơm kim tiêm dùng một lần.Lịch sử phát triển Fibroscan®Nghiên cứu Fibroscan được thực hiện ở Pháp bắt đầu từ năm 1998, đến năm 2001 công ty Echosens chính thức hoàn thiện sáng chế máy Fibroscan ứng dụng trong y học để đánh giá mức độ xơ hóa gan. Máy này được nghiên cứu thí nghiệm ở Pháp trước khi tiến hành ở quy mô lớn trong khoảng thời gian năm 2001-2002. Năm 2002, Fibroscan được đưa vào thử nghiệm tại các viện nghiên cứu đa trung tâm ở Pháp. Đến năm 2003 máy Fibroscan chính thức được cấp giấy chứng nhận CE (Conformity European) của 25 nước thuộc khối liên minh Châu Âu. Đến năm 2005-2006 máy Fibroscan được đưa vào thử nghiệm tại các viện nghiên cứu đa trung tâm của Mỹ và hiện tại Fibroscan đang trong thời gian chờ cơ quan quản lý thực phẩm và dược phẩm Mỹ (FDA) phê chuẩn để đưa vào sử dụng rộng rãi. Từ khi ra đời đến tháng 5/2007 có tổng số 254 máy Fibroscan được đưa vào sử dụng trên toàn thế giới, trong đó Châu Âu có 175 máy, Bắc Mỹ 10 máy, Trung Đông 4 máy, Nga 3 máy và châu Á có 63 máy. Việt Nam hiện tại có hai máy Fibroscan đang được sử dụng ở Trung tâm Medic thành phố Hồ Chí Minh và bệnh viện Bạch Mai.Cấu tạo và nguyên lý hoạt động của FibroscanFibroscan là thiết bị không xâm nhập đầu tiên dùng trong chẩn đoán và theo dõi xơ gan. Thiết bị này được chế tạo bởi công ty Echosens (Pháp), nó được cấu tạo bởi 3 phần: một đầu dò chuyên dụng, một hệ thống siêu âm được gắn với hệ thống đo đàn hồi trong máy Fibroscan và một chương trình phần mềm đặc biệt mà có khả năng mô tả những thông tin thu được khi thực hiện đặt đầu dò thăm khám. Đây là biện pháp thăm khám mới đem đến lợi ích cho tất cả những bệnh nhân mắc bệnh gan mạn tính đặc biệt những bệnh nhân có nguy cơ chảy máu và những bệnh nhân từ chối sinh thiết gan. Hoạt động của Fibroscan dựa trên nguyên lý đàn hồi tạm thời một chiều, một kỹ thuật sử dụng cả sóng siêu âm (5-9MHz) và sóng đàn hồi tần số thấp (50Hz), sự truyền vận tốc của các sóng này liên quan trực tiếp tới tính đàn hồi. Fibroscan là một kỹ thuật không xâm lấn, bệnh nhân không đau, thực hiện nhanh chóng và khách quan để định lượng xơ hóa gan. Đánh giá độ đàn hồi đạt được nhờ vận tốc sóng đàn hồi tần số thấp ở vùng quan tâm (region interest) được xác định từ 2,5cm đến 6,5 cm bên dưới bề mặt da.Vùng quan tâm này được chọn tránh mô dưới da và bao xơ của gan ở đa số các bệnh nhân và đảm bảo rằng các chỉ số nhiễu của siêu âm cho phép đánh giá tốt các biến dạng của mô. Sóng đàn hồi tần số thấp chủ yếu là sóng dịch chuyển theo chiều dọc, bình thường sự lan truyền sóng này với vận tốc 1,1m/s, trong khi đó sóng siêu âm rất nhanh (khoảng 1500m/s). Nếu gan càng xơ hóa tức là nhu mô gan càng cứng thì vận tốc sóng đàn hồi càng nhanh do đó chỉ số Fibroscan càng cao. Việc chẩn đoán tương tự như siêu âm, đầu dò của máy được đặt ở kẽ hai xương sườn trên thành ngực tương ứng với thùy phải và/ hoặc thùy trái của gan, thời gian đo trong vòng vài phút (≤ 5 phút). Về kết quả, máy sẽ hiển thị bằng một con số đơn vị KPa. Kết quả này chính là giá trị trung vị của khoảng tứ phân vị (IQR) được tính như sau: Đơn vị này nói lên độ cứng của gan tương ứng với số tế bào xơ hóa. Điểm từ 1-75.5 Kpa được chia thành 5 giai đoạn theo mức độ xơ hóa theo phân loại METAVIR. Kỹ thuật Fibroscan áp dụng tốtn nhất trong chẩn đoán xơ gan và các bệnh lý viêm gan do virus đặc biệt là viêm gan virus C, B, viêm gan do rượu, do ngộ độc thuốc, gan nhiễm mỡ, cũng như theo dõi diễn biến phục hồi của bệnh lý gan khi điều trị nhằm xác định mức độ xơ hóa gan, điều này rất hữu ích cho các nhà lâm sàng trong chẩn đoán và điều trị. Ngoài ra, Fibroscan còn được chỉ định rộng rãi cho các trường hợp kiểm tra sức khỏe theo yêu cầu hay chỉ định thăm khám cho các đối tượng có nguy cơ cao như: người uống nhiều rượu, điều trị thuốc lao lâu dài, bệnh gan bẩm sinh cũng như thep dõi diễn tiến trước và sau ghép gan.Quá trình thăm khám bệnh nhân bằng kỹ thuật Fibroscan rất thuận lợi: không cần chuẩn bị bệnh nhân trước, thời gian khám và xác định kết quả ngắn(khoảng 5 phút). Kết quả khách quả không phụ thuộc vào ý kiến chủ quan của các bác sĩ như trong thăm khám siêu âm, nó thể hiện bằng con số định lượng là kilo Pascal. Ý nghĩa các thông tin trên kết quả siêu âm FibroscanTrên phiếu kết quả siêu âm Fibroscan có một số thông tin trong đó có kết quả quan trọng nhất là độ cứng của gan. Độ cứng của gan nằm trong ô Sttifness, đơn vị đo là kilopascal. Tùy theo giai đoạn xơ hóa và nguyên nhân mà độ cứng của gan có các giá trị khác nhau.- Một số thông tin khác:• Tỷ lệ thành công: nằm trong ô “success rate”, tỉ lệ thành công từ 60% trở lên thì kết quả đo độ cứng của gan mới được chấp thuận;• IQR (kPa) Interquartile range: khoảng tứ phân vị, khoảng tứ phân vị nhỏ hơn hoặc bằng 20% so với độ cứng của gan thì kết quả đo độ cứng của gan mới được chấp nhận;• CS (kPa) Current Stiffness: độ cứng của gan hiện tại, một con số trong 10 lần đo. 10 con số ứng với 10 lần đo. Từ 10 con số này sẽ tính ra độ cứng của gan.Tuy nhiên cũng giống như các thiết bị chẩn đoán khác, Fibroscan sẽ đưa ra những sai số nều thực hiện ở người béo phì hoặc lớp mỡ dưới da quá dày hoặc người có nhiều dịch cổ trướng và ở những người có khoang liên sườn quá hẹp. Fibroscan và viêm gan C mạn tínhCách thực hiện Fibroscan;-Chuẩn bị máy và bệnh nhân: Thiết bị được sử dụng để đo độ cứng của gan là máy siêu âm Fibroscan do hãng Echosens của Pháp chế tạo;-Bệnh nhân không cần chuẩn bị gì trước. Tư thế bệnh nhân là bệnh nhân nằm ngửa với cánh tay phải dạng tối đa;-Kỹ thuật siêu âm Fibroscan: siêu âm Fibroscan được thực hiện trên thùy phải của gan, sóng siêu âm và sóng đàn hồi xuyên qua khoảng trống giữa các xương sườn để tạo nên độ cứng của gan;-Các bước siêu âm Fibroscan: (i) Bệnh nhân nằm ngửa với cánh tay phải dạng tối đa và bộc lộ vùng gan; (ii) Xác định vị trí đặt đầu dò thường là khoang liên sườn VIII, IX đường nách trước bên (P); (iii) Bôi gel tại vùng định sieu âm; (iv) Đặt đầu dò đúng vị trí vừa bôi gel; (v) Bấm nút, này sẽ tự động phát và thu sóng, và sẽ hiện thị kết quả lần đo thứ nhất (kPa). Thực hiện 10 lần như vậy máy hiển thị tất cả 10 con số và tự động tính ra độ cứng của gan kPa.-Giá trị độ cứng của gan ở bệnh nhân viêm gan C mạn tính:+ Độ cứng của gan ở người bình thường là 4,5kPa. Độ cứng của gan ở bệnh nhân viêm gan mạn tính tăng dần theo giai đoạn xơ hóa, giai đoạn xơ hóa càng cao thì độ cứng của gan càng tăng. Giai đoạn xơ hóa của viêm gan mạn tính được đánh giá theo hệ thống thang điểm Metavir từ F0 đến F4, tương ứng với mỗi giai đoạn xơ hóa có các ngưỡng tương ứng độ cứng của gan. Ngưỡng này thay đổi tùy vùng lãnh thổ, trong cùng một lãnh thổ thì thay đổi tùy theo nguyên nhân gây ra viêm gan mạn tính.+ Trong nghiên cứu của Ogawa E và đồng nghiệp, ở những bệnh nhân viêm gan virus C mạn tính, giá trị ngưỡng ứng với từng giai đoạn xơ hóa là 6,3 kPa với Fo, 6,7kPa với F1, 9,1kPa với F2 và 13,7kPa với F3.+ Trong nghiên cứu của Fraquelli M và đồng nghiệp ở bệnh nhân viêm gan mạn tính, (77,5 % là virus viêm gan C mạn tính, 8% do virus viêm gan B mạn tính) thì giá trị ngưỡng tương ứng với từng giai đoạn xơ hóa là 7,9kPa với F2, và 10,3 kPa với F3;+ Trong nghiên cứu của Lusor M và đồng nghiệp ở những bệnh nhân viêm gan C mạn tính thì ngưỡng tương ứng với từng giai đoạn xơ hóa là 4,9 kPa với F1, 7,4kPa với F2, và 9,1 kPa với F3;+ Trong nghiên cứu của Castera l và đồng nghiệp ở những bệnh nhân viêm gan virus C mạn thì ngưỡng đối với từng giai đoạn xơ hóa là: 7,1kPa với F2 và 9,5 kPa với F3;+ Trong nghiên cứu của Serejo F và đồng nghiệp thì ngưỡng tương ứng với từng giai đoạn xơ hóa là 5,4kPa với F2 và 8,2kPa với F3.Một số nét về thử nghiệm FibroTestFibro Test là một trong các xét nghiệm sinh hóa có giá trị đo đạt mức độ xơ hóa của gan. Fibro Test được xác định ban đầu ở những bệnh nhân viêm gan C mạn tính sau đó đến các nguyên nhân gây xơ gan phổ biến khác như: viêm gan B, viêm gan do rượu và viêm gan không do rượu. FibroTest gồm có 5 chỉ số sinh hóa: Alpha2-macroglobulin (g/l), Haptoglobin (g/l), Apolipoprotein A1 (g/l), GGT (gamma glutamyl transpeptidase) (IU/l), Bilirubin toàn phần (micromol/l). Một trong những vấn đề lâm sàng quan trọng là làm thế nào để đánh giá tốt nhất và quản lý một số lượng ngày càng tăng của những bệnh nhân bị nhiễm virus viêm gan C. Sinh thiết gan được đề nghị trong hầu hết các bệnh nhân viêm gan C. Tuy nhiên nhiều nghiên cứu đã đề nghị rằng sinh thiết gan có nhiều hạn chế và rủi ro, đồng thời nhằm mục đích cải thiện tính chính xác chẩn đoán của các xét nghiệm sinh hóa, sinh thiết gan không còn được coi là chỉ định bắt buộc. Trong lựa chọn thay thế không xâm lấn cho sinh thiết gan, một số nghiên cứu đã chứng minh giá trị tiên đoán FibroTest - loại xét nghiệm sinh hóa huyết thanh trong đánh giá mức độ xơ hóa của gan ở bệnh nhân nhiễm HCV (FT; Biopredictive, Paris, France; HCV - Fibrosure, Labcorp, Burlington, USA), kết quả tương tự không thu được đối với các xét nghiệm khác. Từ tháng 9.2002 đến tháng 4.2007, rất nhiều nghiên cứu đãđược tiến hành và đưa đến hai kết luận chính:-FT được nghiên cứu chủ yếu trong bệnh viêm gan C mạn tính;-FT có giá trị thấp hơn cho giai đoạn xơ hóa trung gian (có bắc cầu hay không bắc cầu) so với giá trị trong phân độ giai đoạn có xơ gan hay không có xơ gan, điều này tương tự như sinh thiết gan. Từ năm 2002, FibroTest đã được sử dụng ở một số nước như là một xét nghiệm thay thế cho sinh thiết gan. -Trong một nghiên cứu gần đây, FibroTest đã được chỉ ra rằng là xét nghiệm sinh hóa huyết thanh có thể có giá trị lớn nhất trong dự đoán mức độ xơ hóa của gan hay xơ gan.Cách lấy máu: Khi được bác sĩ chỉ định, bệnh nhân đến phòng xét nghiệm lấy 1 ml máu huyết thanh, không cần chất chống đông và không cần phải nhịn đói, mẫu huyết thanh của bệnh nhân sẽ được gửi đến trung tâm xét nghiệm và có kết quả ngay trong vòng 4 giờ. Huyết thanh có thể được lưu giữ không quá 72 giờ ở nhiệt độ +2°C/+8°C và tránh ánh nắng mặt trời (tránh bilirubin không bị phân hủy). Nếu các thông số không thể đo trong khoảng thời gian cần thiết, huyết thanh phải được ngay lập tức đông lạnh ở -80°C trong tối đa 5 ngày, mẫu đông lạnh không được rã đông nhiều lần. Sau khi rã đông, ở nhiệt độ phòng thí nghiệm huyết thanh phải được li tâm 1500 vòng/ 10 phút và hiển thị các kết quả. Điểm số Fibrotest tính và đánh giá mức độ xơ hóa của gan ở bệnh nhân viêm gan C theo thang điểm Metavir:Giá trị chẩn đoán của FibroTest không có khác biệt cho các mức kế cận nhau cũng như cho các mức cực điểm. Lợi ích của FibroTest đã được chứng minh trong việc chẩn đoán ban đầu mức độ xơ gan cũng như trong việc theo dõi bệnh nhân (điều trị hay không điều trị). Vào năm 2006, Cơ quan Y tế cao nhất của Pháp đã có khuyến cáo sử dụng FibroTest như xét nghiệm đầu tay để đánh giá mức độ xơ hóa gan trong trường hợp viêm gan siêu vi C mạn chưa điều trị. Đọc kết quả:Kết quả FibroTest dao động trong khoảng từ 0 đến 1, tỷ lệ với mức độ xơ hóa của gan được quy chiếu theo hệ thống METAVIR (từ F0 đến F4). Nhằm đơn giản hóa việc diễn giải kết quả khi nhìn, kết quả luôn kèm theo một hình vẽ màu có ba mức độ tùy theo độ nặng:• Màu xanh lá cây (không có hoặc không đáng kể);• Màu cam (mức độ trung bình);• Màu đỏ (đáng kể).FibroTest được quy đổi thành các mức theo ba mức phân lọai mô học thường được sử dụng nhất (METAVIR, Knodell và Ishak) trong bảng sau:-FibroTest đã được lượng giá so sánh với sinh thiết gan trên một số lượng rất lớn bệnh nhân nhiễm viêm gan siêu vi C (n = 4.600) và đã được tiến hành trên hơn 350.000 bệnh nhân (2008);-Giá trị chẩn đóan của FibroTest không có khác biệt giữa các chủng tộc, giới tính, genotype, lượng virus, nồng độ men gan, các yếu tố bệnh lý đi kèm. Bảng. Mức độ xơ hóa gan được ước lượng theo các tác giả FibroTest | METAVIR | Knodell | Ishak | 0.75-1.00 | F4 | F4 | F6 | 0.73-0.74 | F3-F4 | F3-F4 | F5 | 0.59-0.72 | F3 | F3 | F4 | 0.49-0.58 | F2 | F1-F3 | F3 | 0.32-0.48 | F1-F2 | F1-F3 | F2-F3 | 0.28-0.31 | F1 | F1 | F2 | 0.22-0.27 | F0-F1 | F0-F1 | F1 |
FibroTest có thể áp dụng được trong 95-99% trường hợp. Xét nghiệm này đã được nghiên cứu trong các bệnh lý sau đây :
• Viêm gan mạn do siêu vi C;• Viêm gan mạn do siêu vi B;• Viêm gan mạn do siêu vi C hoặc B và HIV;• Bệnh gan do rượu (gan nhiễm mỡ và viêm gan nhiễm mỡ);• Gan nhiễm mỡ và viêm gan nhiễm mỡ không do rượu (tiểu đường, thừa cân, tăng triglyceride, bất thường cholesterol, cao huyết áp).Xét nghiệm rất hiệu quả và được chứng minh trên các đối tượng nghiên cứu chuyên biệt sau:• Đối tượng trên 65 tuổi;• Trẻ em;• Bệnh nhân suy thận và ghép thận;• Bệnh ưa chảy máu;• Bệnh nhân có các bệnh viêm mạn tính;• Dân số trong cộng đồng.Các xét nghiệm không thể áp dụng được chỉ chiếm khoảng 1 đến 5% trường hợp: • Viêm gan cấp (ví dụ viêm gan cấp do virus viêm gan A, B, C, D, E; viêm gan cấp do thuốc);• Ứ mật ngoài gan (ví dụ: ung thư tụy, sỏi ở đường mật chính);• Thiếu máu tan máu nặng;• Hội chứng Gilbert cùng với tăng mạnh bilirubine gián tiếp trong máu;• Hội chứng viêm cấp (chỉ cần dời lại việc thử máu); Ưu nhược điểm của FibroTestSinh thiết gan FibroTest: Tỷ lệ biến chứng là 0,6%;Tử vong 0,03%;Một mẫu máu đơn giản, phòng thí nghiệm gần nhất;Sai lầm do chọn mẫu bệnh phẩm;Độ dài của các mẫu sinh thiết gan khi lấy khác nhau: từ 5 đến 30mm;Độ chính xác cao của một định lượng hóa học (hệ số dao động < 5%);Dao động do các lần đo khác nhau của cùng một người thực hiện hoặc giữa nhiều người thực hiện khác nhau;Khả năng lặp lại xuất sắc bởi cùng một phòng xét nghiệm hay bởi các phòng xét nghiệm khác nhau-Tiêu chuẩn vàng không hoàn hảo: nguy cơ dương tính giả hoặc âm tính giả nhất là khi mẫu sinh thiết quá bé;-Giá trị chẩn đoán và giá trị tiên lượng tương đương với mẫu sinh thiết gan dài 25mm;-Khó lặp lại;-Dễ dàng lặp lại nhiều lần;-Không áp dụng được bằng đường gian sườn khi có rối loạn đông máu hoặc có
dịch cổ trướng;-Chống chỉ định khi có suy hô hấp nặng;-Không áp dụng được trong trường hợp viêm gan cấp, ứ mật ngòai gan, huyết tán nặng, hội chứng Gilbert kèm theo tăng mạnh Bilirubine gián tiếp (trong trường hợp có hiện tượng viêm cấp, chỉ cần dời chỉ định xét nghiệm máu lại một thời gian);-Rất bất lợi khi xét trên mối tương quan lợi và hại;-Mối tương quan xuất sắc giữa lợi và hại;-Cho phép chẩn đoán các tổn thương liên quan đến xơ hóa gan như họat động viêm hoại tử, gan nhiễm mỡ, gan ứ sắt, granulome và các tổn thương khác hiếm gặp hơn;-Phối hợp các xét nghiệm không xâm lấn khác của BioPredictive cho phép chẩn đoán các thương tổn thường phối hợp với xơ hóa gan: họat động viêm và họai tử (ActiTest) và gan nhiễm mỡ (SteatoTest). Đối tượng nghiên cứu: gồm các bệnh nhân được chẩn đoán viêm gan virus C mạn tính điều trị nội trú hoặc ngoại trú khoa tiêu hóa BV Bạch Mai;- Tiêu chuẩn lựa chọn bệnh nhân:+Bệnh nhân được chẩn đoán viêm gan virus C mạn tính theo tiêu chuẩn Lok A và Gounaratnam N (1997);+Anti-HCV (+) kéo dài trên 6 tháng;+HCV - RNA dương tính;+Sinh thiết gan có tổn thương xơ hóa ≥ F1 theo phân loại Metavir;+ALT có thể bình thường hoặc tăng;+Bệnh nhân đồng ý tham gia nghiên cứu.-Tiêu chuẩn loại trừ: BN được chẩn đoán viêm gan virus C mạn tính loại ra khỏi
nghiên cứu nếu có một trong các triệu chứng sau: -Đồng nhiễm virus B và/ hoặc HIV;-Có biến chứng xơ gan mất bù: cổ trướng, xuất huyết tiêu hóa, nhiễm trùng dịch cổ trướng;-Bệnh nhân nghiện rượu (nam uống 30g ethanol/ ngày, nữ uống 20g ethanol/ ngày trong 5 năm trở lại);-Bệnh nhân làm siêu âm 2D có khối trong gan;-Phụ nữ có thai;-Mảnh sinh thiết gan không đủ để chẩn đoán mô bệnh học;-Kết quả Fibroscan không được chấp nhận.- Phương pháp nghiên cứu: Thiết kế nghiên cứu tiến cứu, mô tả cắt ngang. Thu thập thông tin theo mẫu bệnh án nghiên cứu thống nhất.- Cỡ mẫu nghiên cứu: cỡ mẫu thuận tiện lấy tất cả các bệnh nhân thỏa mãn tiêu chuẩn nghiên cứu điều trị nội trú và ngoại trú khoa tiêu hóa BV Bạch Mai.- Phương pháp thu thập số liệu: Tất cả các bệnh nhân đủ tiêu chuẩn nghiên cứu sẽ được hỏi bệnh, thăm khám tỉ mỉ và làm các xét nghiệm máu: Đông máu cơ bản: PT %; Tế bào máu ngoại vi: Tiểu cầu, hồng cầu và bạch cầu. Sinh hóa máu: glucose máu, chức năng thận (ure, creatinin, điện giải đồ), các xét nghiệm đánh giá chức năng gan: protein toàn phần, albumin, tỷ lệ A/G, mỡ máu, GOT, GPT, GGT, bilirubin toàn phần và bilirubin trực tiếp Nghiên cứu chẩn đoán mức độ xơ hóa gan bằng phương pháp đo độ đàn hồi gan trên bệnh nhân viêm gan mạn của nhóm tác giả Ngô Thị Thanh Quýt, Nguyễn Phương, Lê Thành Lý, Bùi Hữu Hoàng cho thấy việc tiên lượng và điều trị bệnh gan mạn tính phụ thuộc vào diễn tiến và mức độ xơ hóa gan. Sinh thiết gan được xem là tiêu chuẩn vàng trong chẩn đoán mức độ xơ hóa gan, tuy nhiên đây là biện pháp xâm lấn khó có thể áp dụng rộng rãi. Vì vậy, cần có những phương pháp không xâm lấn có thể phản ảnh chính xác mức độ xơ hóa gan. Đo độ đàn hồi gan là phương pháp mới không xâm lấn có thể đo được độ cứng của gan. Ở bệnh nhân xơ gan, độ cứng của gan dao động từ 12,5-75 kPa. Với mục tiêu xác định độ nhạy (Se), độ đặc hiệu (Sp), giá trị tiên đoán dương tính (PPV), giá trị tiên đoán âm tính (NPV) của phương pháp đo độ đàn hồi gan trong đánh giá mức độ xơ hóa gan ở bệnh nhân bị bệnh gan mạn tính. Nghiên cứu tiền cứu trên 47 bệnh nhân có bệnh gan mạn do nhiều nguyên nhân khác nhau. Tất cả bệnh nhân được khám lâm sàng và làm các xét nghiệm sinh hóa, siêu âm bụng và đo độ đàn hồi gan bằng máy Fibroscan(r). Sinh thiết gan được đánh giá kết quả theo thang điểm METAVIR. Kết quả cho thấy có mối tương quan chặt chẽ giữa mức độ xơ hóa gan (theo METAVIR) với độ đàn hồi gan. Ở mức độ xơ hóa gan trung bình (F ≥ F2), diện tích dưới đường cong (AUROC) là 0,811; tại giá trị ngưỡng là 7,9 kPa, Se là 88%, Sp là 73%, PPV là 88% và NPV là 77%. Ở mức độ xơ hóa gan nặng (F ≥ F3), AUROC là 0,887; tại giá trị ngưỡng là 11,68 kPa, Se là 73%, Sp là 84%, PPV là 80% và NPV là 78%. Để chẩn đoán xơ gan (F4), AUROC là 0,919; tại giá trị ngưỡng là 22,37 kPa., Se là 70%, Sp là 95%, PPV là 78% và NPV là 92%. Ddieuf này cho thấy đo độ đàn hồi gan bằng máy Fiboscan là phương pháp không xâm lấn, đơn giản giúp ước lượng mức độ xơ hóa gan tương đối phù hợp với kết quả sinh thiết gan. Tóm lại, FibroTest có giá trị chẩn đoán tương đương với mẫu sinh thiết gan dài 25 mm, với lợi thế là xét nghiệm không xâm lấn và việc diễn giải kết quả rất dễ dàng.Các dấu ấn không xâm lấn xác định mức độ tổn thương gan: hữu ích hay vô ích? ·Sinh thiết gan cho phép đánh giá chính xác giai đoạn xơ hóa, sử dụng hệ thống tính điểm bán định lượng, bao gồm cả đánh giá rối loạn cấu trúc và sự tích tụ xơ; ·Các dấu ấn xơ hóa không xâm lấn hữu ích để sàng lọc xơ gan nhưng không đủ chính xác để xác định giai đoạn hóa xơ; ·Xơ gan chỉ là một khía cạnh của viêm gan do virus mạn tính, cần được diễn giải trong bối cảnh mô học đầy đủ của bệnh. Xơ gan là một đáp ứng mô không đặc hiệu đối với viêm mạn tính, liên quan với tổn thương mô chưa được giải quyết. Xơ gan - giai đoạn kết thúc của xơ hóa và là nguyên nhân chính của tỷ lệ mắc bệnh và tỷ lệ tử vong trong bệnh gan mạn tính. Vì vậy, việc đánh giá mức độ hay giai đoạn xơ hóa thường là một điều kiện tiên quyết đối với việc quản lý và theo dõi bệnh nhân bị bệnh gan mạn tính. Do xơ hóa là sự tổn thương mô, sinh thiết - theo định nghĩa - là công cụ trực tiếp duy nhất, tuy xâm lấn nhưng đánh giá được sự xơ hóa trong khi các phương pháp không xâm lấn (các dấu ấn trong huyết thanh hoặc kỹ thuật vật lý và/ hoặc hình ảnh) là những cách tiếp cận gián tiếp thay thế. Trong chương này, điểm mạnh và điểm yếu của các dấu ấn không xâm lấn và sinh thiết gan được xem xét và vai trò riêng của chúng trong việc quản lý bệnh nhân bị viêm gan do virus mạn tính được bàn luận. Lựa chọn thay thế chính cho sinh thiết gan dựa trên 2 phương pháp rất khác nhau là các dấu ấn trong huyết thanh và độ cứng của gan. Hai phương pháp này có những nguyên tắc cơ bản khác nhau đáng kể, nhưng cả hai đều có lợi ích rõ ràng: không xâm lấn. Mặc dù các phương pháp này tạo ra chi phí đáng kể và không phải là phổ biến, các dấu ấn không xâm lấn dễ sử dụng, thích nghi tốt với việc sàng lọc đại trà và cùng với một số biện pháp phòng ngừa đầy đủ, có thể được xem là những thủ thuật có thể nhân rộng cao. Độ cứng của gan, được đánh giá bằng siêu âm (Fibroscan) và gần đây hơn bằng chụp cộng hưởng từ (MRI) đánh giá được tốc độ lan truyền của sóng xung kích trong mô gan. Phương pháp này đo các thông số vật lý của mô gan liên quan đến độ đàn hồi của nó. Điều hợp lý là ở chỗ gan bình thường trơn láng và không thuận lợi cho sự lan truyền sóng, trong khi sự xơ hóa làm tăng độ cứng của mô và làm thuận lợi cho sự lan truyền sóng nhanh hơn. Mặt hạn chế chính là các tổn thương chiếm chỗ thêm ở gan, như sự nhiễm mỡ, phù và viêm xuất hiện trong cơ quan được bọc trong một bao có thể căng phồng nhưng không đàn hồi (bao Glisson). Điều này góp phần làm thay đổi kết cấu của gan và tác động như một yếu tố cản trở trong đó độ cứng có liên quan. Tuy nhiên, kết quả của các nghiên cứu lớn đánh giá hàng ngàn bệnh nhân đã xác nhận rằng tính đàn hồi song song với tình trạng xơ hóa ở các giai đoạn tiền xơ gan hoặc xơ gan. Một nghiên cứu tổng hợp về Fibroscan mới đây đã cho thấy là diện tích dưới đường cong đặc trưng hoạt động của bộ thu nhận (AUROC) có tương quan rất cao với sự hiện diện của xơ gan. Tuy nhiên, điều đáng chú ý là cách tiếp cận này về cơ bản có giá trị cho việc chẩn đoán xơ gan nhưng không đủ để đánh giá xơ hóa nhẹ hơn hoặc sự chuyển tiếp từ một giai đoạn đến giai đoạn cao hơn. Cuối cùng, lợi ích tiềm năng thêm của Fibroscan là ở chỗ nó cho một phạm vi rộng các trị số về độ cứng trong nhóm lớn gan xơ hóa, khắc phục được một trong những hạn chế chính của sinh thiết (tức là một giai đoạn về mô học cho tất cả các dạng xơ gan) và do đó có thể cho giá trị tiên lượng thêm trong nhóm này. Các dấu ấn trong huyết thanh đại diện cho sự kết hợp các thành phần trong máu được tối ưu hóa để phản ánh giai đoạn mô học của xơ gan. Hiện có một số dấu ấn có trên thị trường. Mặc dù có một số lượng lớn các kết hợp được đề xuất, tất cả đều được thiết kế theo cùng một cách: kết hợp và tối ưu hóa sự lựa chọn các thông số trong máu đã xác định trước để phù hợp với các giai đoạn mô học càng nhiều càng tốt ở nhóm bệnh nhân đã được sinh thiết gan và đo chỉ điểm trong huyết thanh. Điều này về cơ bản khác với Fibroscan. Trong khi Fibroscan đánh giá một đặc tính thực của mô gan (tức là độ cứng), thuật toán chỉ điểm trong huyết thanh được thiết kế để cho kết quả sinh thiết tương tự bất kể độ chính xác của sinh thiết. Vì vậy, bất kỳ hạn chế nào của thủ thuật sinh thiết (ví dụ sự biến thiên khi lấy mẫu) sẽ làm giảm chức năng của việc đo chỉ điểm trong huyết thanh. Tuy nhiên, chỉ điểm trong huyết thanh được thử nghiệm rộng rãi nhất đã chứng tỏ độ chính xác chấp nhận được trong việc chẩn đoán phân biệt xơ hóa có ý nghĩa và không có ý nghĩa . Các chỉ điểm thay thế đã được thiết lập và được thử nghiệm để tách biệt xơ hóa có ý nghĩa so với không có ý nghĩa. Điều này được áp đặt bằng cách sử dụng diện tích dưới đường cong đặc trưng hoạt động của bộ thu nhận (AUROC) là cách kiểm tra giả thuyết nhị phân. Khi sử dụng cách tiếp cận này, có sự mất thông tin đáng kể. Trong hầu hết nghiên cứu, những hạn chế này đã được bỏ qua bằng cách xem các giai đoạn mô học khác nhau là các biến số tuyến tính và là các trị số trung gian ngoại suy đối với mỗi giai đoạn. Tuy nhiên, đây là một giả định sai lầm vì điểm số là các loại mà không phải là các biến số liên tục. Sự phỏng đoán này giải thích lý do tại sao khi chỉ xem xét các giai đoạn liền kề (F1 so với F2, hoặc F2 so với F3), các trị số AUROC thấp không thể chấp nhận được, dẫn đến giả định rằng những chất thay thế này là những công cụ không đầy đủ để xác định từng giai đoạn riêng biệt. Đánh giá mô học xâm lấn nhu mô gan - Sinh thiết gan Sinh thiết gan đã được xem là “chuẩn vàng” để đánh giá tổn thương mô kể cả sự xơ hóa. Tuy nhiên, các hạn chế được công nhận liên quan đến thủ thuật này đã thúc đẩy sự thảo luận về vị trí sinh thiết gan trong việc quản lý bệnh nhân bị viêm gan do virus mạn tính. Mặt hạn chế chính của sinh thiết gan là việc lấy mẫu và các lỗi quan sát. Những lỗi này đặc hiệu đối với sinh thiết và về lý thuyết cần được loại bỏ khi sử dụng phương pháp đo chỉ điểm trong huyết thanh. Vì sinh thiết gan chỉ liên quan đến một phần rất nhỏ của toàn bộ cơ quan, có nguy cơ là vùng được sinh thiết có thể không thích hợp để đánh giá bất kỳ tổn thương nào trong toàn bộ gan do tính không đồng nhất về sự phân bố của nó. Dữ liệu rộng rãi trong y văn đã cho thấy là tăng độ dài của mảnh sinh thiết gan làm giảm nguy cơ sai sót khi lấy mẫu Ngoại trừ xơ gan mà đối với trường hợp này những mảnh rất nhỏ cũng có thể đủ, một mảnh sinh thiết cỡ 25 mm được xem là một mẫu tối ưu cho việc đánh giá chính xác, mặc dù 15 mm được xem là đủ trong hầu hết các nghiên cứu. Sự khác nhau giữa các người quan sát là một hạn chế có thể có khác của việc sinh thiết, liên quan đến sự không phù hợp giữa các nhà bệnh lý học khi diễn giải kết quả sinh thiết. Việc sử dụng hệ thống tính điểm về mô học để đánh giá xơ hóa và viêm hoại tử hạn chế được trở ngại này và một số nghiên cứu cho thấy là sự phù hợp giữa các nhà bệnh lý học được xem là thỏa đáng, đặc biệt khi việc xác định giai đoạn xơ hóa được thực hiện bởi các nhà bệnh lý học chuyên về gan. Như vậy, mặc dù sinh thiết gan có những mặt hạn chế của nó, các biện pháp phòng ngừa thích hợp có thể làm giảm những sai sót vốn có của phương pháp này. Vì sinh thiết gan là phương pháp xâm lấn, hạn chế lớn duy nhất đối với việc sử dụng phương pháp này là khả năng có các tác tác dụng ngoại ý và biến chứng, đã từng được xem xét toàn diện trong một số nghiên cứu. Thường gặp đau thoáng qua và trung bình, cùng với lo âu và khó chịu. Các biến chứng nặng như tràn máu màng bụng, viêm màng bụng mật và tràn khí màng phổi hiếm gặp (0,3-0,5%). Tử vong cực kỳ hiếm gặp, nhưng thỉnh thoảng được báo cáo đối với các sinh thiết trong bệnh gan tiến triển, các khối u xuất huyết và ở những bệnh nhân bị bệnh kèm theo nặng. Sinh thiết qua đường tĩnh mạch cảnh làm giảm đáng kể nguy cơ xuất huyết ở những bệnh nhân bị bệnh gan tiến triển và rối loạn đông máu. Việc thực hiện sinh thiết bởi một bác sĩ đã qua huấn luyện, chỉ sử dụng một số giới hạn đường đi xuyên qua và với sự hướng dẫn của siêu âm có thể làm giảm đáng kể nguy cơ bị các biến chứng, nhờ đó làm tăng độ an toàn của việc sinh thiết. Tuy nhiên, chỉ nên thực hiện sinh thiết gan sau khi đã cân nhắc kỹ các nguy cơ của thủ thuật so với lợi ích có thể có về mặt quản lý bệnh nhân. Bỏ qua những hạn chế này, sinh thiết gan cung cấp những thông tin vô giá mà không có các chỉ điểm không xâm lấn nào cung cấp được. Do độ chính xác của chúng, hệ thống tính điểm được chuẩn hóa để đánh giá xơ hóa (xác định giai đoạn) đã chứng tỏ là thích hợp để mô tả lịch sử tự nhiên của bệnh gan mạn tính bằng cách đánh giá tốc độ tiến triển của bệnh. Mặc dù được ủng hộ mạnh mẽ như là một tiêu chuẩn quyết định chính đối với các chuyên gia về gan, xơ hóa chỉ là một trong nhiều đặc điểm mô học cơ bản hiện diện đồng thời khi sinh thiết gan. Thật vậy, xơ hóa không phải là một đặc điểm tự động mà đúng hơn là mô sẹo do các cơ chế bệnh lý học như quá trình viêm, thoái hóa hoặc loạn dưỡng. Việc đánh giá đồng thời viêm hoại tử (viêm khoảng cửa, viêm gan tiếp giáp, viêm tiểu thùy) cho phép đánh giá có phải xơ hóa là kết quả của một hiện tượng trước đây đã ổn định hoặc thậm chí thoái lui, hay là một quá trình đang diễn ra mà có thể tiếp tục xấu đi. Sinh thiết cũng thường phát hiện các tổn thương liên quan như nhiễm mỡ, viêm gan nhiễm mỡ và thừa sắt, cung cấp thông tin hữu ích cho việc quản lý và tiên lượng bệnh nhân. Cuối cùng, điều đáng chú ý là ở những bệnh có gánh nặng chi phí cao như viêm gan C, sinh thiết gan cũng có thể phát hiện các xét nghiệm chức năng gan bất thường có liên quan với một bệnh gan khác thêm ngoài dự kiến. Rõ ràng, tất cả các thông tin này có thể ảnh hưởng đến việc quản lý bệnh nhân. Vì vậy, việc đặt ngang hàng bệnh gan mạn tính với mức độ xơ hóa mà thôi là một sự đơn giản hóa quá mức có thể gây nhầm lẫn. Các dấu ấn xơ hóa không xâm lấn: hữu ích hay vô ích? Dựa trên việc đánh giá các dấu ấn không xâm lấn ở hàng ngàn bệnh nhân, đã ghi nhận các chỉ điểm thay thế là những phương pháp hữu ích để đánh giá xơ hóa hoặc xơ gan có ý nghĩa nhưng vô ích trong việc theo dõi bệnh nhân hoặc trong trường hợp có bệnh kèm theo (thường được phát hiện khi đọc kết quả sinh thiết). Điều này cho thấy là các chỉ điểm thay thế đơn thuần nên được dùng khi không có sự bất đồng về chỉ định điều trị, ví dụ những bệnh nhân có virus viêm gan C tương đối mới khởi phát (genotype 2 hoặc 3) là những người sẽ luôn được điều trị hoặc những bệnh nhân mà việc điều trị là bắt buộc vì các lý do khác như có biểu hiện ngoài gan nặng. Ngoài ra, không nên sinh thiết gan đối với những bệnh nhân có chống chỉ định với thuốc kháng virus khi đánh giá lần đầu. Trong những tình trạng này, cách đánh giá đơn giản về xơ hóa có ý nghĩa so với xơ hóa không có ý nghĩa bằng một hoặc vài dấu ấn không xâm lấn dường như là đủ, mặc dù nên thực hiện sinh thiết nếu có bất kỳ triệu chứng nào bất thường hoặc tiến triển không điển hình xảy ra. Tương tự, không bắt buộc sinh thiết ở những bệnh nhân bị xơ gan rõ rệt, ở đó sự thực hiện rất tốt của các dấu ấn không xâm lấn cho phép chẩn đoán xác định. Khi có sự bất đồng về việc nên điều trị bệnh nhân hay không, lúc đó sinh thiết cần đi trước. Điều này bao gồm tất cả bệnh nhân bị nhiễm virus viêm gan B và virus viêm gan C (genotype 1). Vì các thuốc kháng virus không có hiệu quả hoàn toàn và có các tác dụng phụ đáng kể, cần đánh giá chính xác tổn thương gan bằng sinh thiết. Mức độ chính xác do sinh thiết gan đem lại đặc biệt quan trọng trong bối cảnh mà ở đó việc xác định giai đoạn thường được sử dụng để xác nhận quyết định điều trị cho bệnh nhân bằng trị liệu kháng virus hoặc để sàng lọc và phòng ngừa các biến chứng như tăng áp lực tĩnh mạch cửa và ung thư biểu mô tế bào gan. Những đánh giá này sẽ dựa vào sinh thiết vì các chỉ điểm không xâm lấn chỉ có thể chẩn đoán chắc chắn xơ gan là giai đoạn mà các trị liệu kháng virus ít hiệu quả và cơ hội chữa khỏi bệnh thấp hơn. Có một nhu cầu cấp bách cần phải theo đuổi việc phát triển các dấu ấn thay thế để xác định giai đoạn xơ hóa. Do mối quan hệ có điều kiện với sinh thiết, việc phát triển các chỉ điểm trong huyết thanh luôn có những hạn chế. Hy vọng là kỹ thuật hình ảnh vật lý cuối cùng sẽ được cải tiến đến một mức độ chính xác chấp nhận được, đặc biệt để đánh giá các giai đoạn sớm của sự xơ hóa. Trong tương lai những xem xét này có thể trở nên không còn giá trị vì việc điều trị kháng virus tiến triển hướng đến các thuốc có hiệu quả cao và có tác dụng ngoại ý ít hơn. Nghiên cứu nhằm xác định vai trò của FibroScan (FS), tiểu cầu (TC), tỷ lệ AST/ALT, APRI, FIB4 trong đánh giá xơ hóa gan. 59 bệnh nhân bệnh gan mạn (50 viêm gan mạn, 9 xơ gan) có sinh thiết gan được đưa vào nghiên cứu từ 1.2007 đến 1.2008. Đánh giá mức độ xơ hóa theo tiêu chuẩn Metavir: xơ hóa có ý nghĩa - F2,3, xơ gan - F4. AUROC của từng chỉ số được thiết lập. Nghiên cứu chúng tôi có: 32,2% - F0, 27,11% - F1, 20,33% - F2; 22,03% - F3; 15,25% - F4. Có mối liên quan chặt chẽ giữa mức độ xơ hóa với FS (r = 0,608) và TC (r = -0,408), APRI (r = 0,55), FIB4 (r = 0,36). AUROC của FS cao hơn các xét nghiệm khác trong đánh giá xơ hóa > F2 và xơ gan- F4. Ở các bệnh nhân có bệnh gan mạn tính, chẩn đoán xơ hóa > F2 của FS, AST/ALT, TC, APRI, FIB4 với độ nhạy (Se) 76,92; 46,5; 51%; độ đặc hiệu (Sp) 92,11; 74,3; 53,1%; chẩn đoán xơ gan với Se: 100; 72,6; 65,3%; Sp: 55,6; 43,2; 42,2%. Các thăm dò không xâm nhập có giá trị đánh giá mức độ xơ hóa tuy nhiên FibroScan là xét nghiệm được ưu tiên khi đánh giá xơ hóa gan. Xơ hóa gan là hiện tượng mất đi tế bào gan, phá hủy vi cấu trúc gan thay thế bởi các tiểu thùy tân tạo và tăng sinh tổ chức xơ toàn bộ gan. Hậu quả cuối cùng của xơ hóa gan chính là xơ gan với rất nhiều biến chứng (bệnh não gan, ung thư gan, tăng áp lực tĩnh mạch cửa, hội chứng gan -thận) và tỷ lệ tử vong rất cao. Bệnh cảnh lâm sàng cuả xơ gan tùy thuộc vào giai đoạn tiến triển và mức độ diễn biến. Ngay cả khi bệnh nhân có xơ gan nhưng ở giai đoạn đầu của bệnh thường không có triệu chứng do gan có khả năng hoạt động bù trừ và tái tạo rất mạnh nên bệnh ở giai đoạn tiềm tàng lâu và khó phát hiện. Còn khi triệu chứng lâm sàng đã rõ thì bệnh dã ở vào giai đoạn nặng, chức năng sinh lý của gan bị hư hại hoàn toàn. Do tính chất phức tạp Tài liệu tham khảo 1.GBD 2013 Mortality and Causes of Death, Collaborators (2014). Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013.". Lancet 385 (9963): 117-71. 2.Brower, Steven T. (2012). Elective general surgery : an evidence-based approach. New York: McGraw-Hill Medical. p. 36. ISBN 9781607951094. 3.Friedman LS (2014). Current medical diagnosis and treatment 2014. [S.l.]: Mcgraw-Hill. pp. Chapter 16. Liver, Biliary Tract, & Pancreas Disorders. ISBN 978-0071806336. 4.Li CP, Lee FY, Hwang SJ et al. (1999). "Spider angiomas in patients with liver cirrhosis: role of alcoholism and impaired liver function". Scand. J. Gastroenterol. 34 (5): 520-3. 5.William, james (2005). Andrews' Diseases of the Skin: Clinical Dermatology. saunders. ISBN 0-7216-2921-0. 6.Slater, Joseph S. Esherick, Daniel S. Clark, Evan D. Current practice guidelines in primary care 2013. New York: McGraw-Hill Medical. pp. Chapter 3: Disease Management. ISBN 0071797505. 7.Van Thiel, DH; Gavaler, JS; Schade, RR (February 1985). "Liver disease and the hypothalamic pituitary gonadal axis.". Seminars in liver disease 5 (1): 35-45. 8.Dan L. Longo (2012). Harrison's principles of internal medicine. (18th ed.). New York: McGraw-Hill. pp. Chapter 308. Cirrhosis and Its Complications. ISBN 9780071748896. 9.Tangerman, A; Meuwese-Arends, MT; Jansen, JB (1994). Cause and composition of foetor hepaticus.". Lancet 343 (8895): 483. 10.Suurmond, D. (2009). Color Atlas and Synopsis of Clinical Dermatology: Common and Serious Diseases. McGraw-Hill. pp. Section 33: Disorders of the nail apparatus. ISBN 978-0071793025. 11.Suurmond, D. (2009). Fitzpatrick's Color Atlas & Synopsis of Clinical Dermatology. 6th ed. New York: McGraw-Hill. pp. Section 33. Disorders of the Nail Apparatus. 12.Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP (2006). "The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide". J. Hepatol. 45 (4): 529-38. 13.Hammer, edited by Stephen J. McPhee, Gary D. (2010). Pathophysiology of disease : an introduction to clinical medicine (6th ed.). New York: McGraw-Hill Medical. pp. Chapter 14: Liver Disease. Cirrhosis. ISBN 978-0071621670. 14.Iredale JP (2003). "Cirrhosis: new research provides a basis for rational and targeted treatments". BMJ 327 (7407): 143-7. 15.Puche, JE; Saiman, Y; Friedman, SL (2013). Hepatic stellate cells and liver fibrosis. Comprehensive Physiology 3 (4): 1473-92. 16.Grant, A; Neuberger J (1999). Guidelines on the use of liver biopsy in clinical practice. Gut 45 (Suppl 4): 1-11. 17.Udell, JA; Wang, CS; Tinmouth, J; FitzGerald, JM; Ayas, NT; Simel, DL; Schulzer, M; Mak, E; Yoshida, EM (2012). "Does this patient with liver disease have cirrhosis?". JAMA: the Journal of the American Medical Association 307 (8): 832-42. 18.Maddrey, edited by Eugene R. Schiff, Michael F. Sorrell & Willis C. (1999). Schiff's diseases of the liver. (11th ed. / edited by Eugene R. Schiff, Willis C. Maddrey, Michael F. Sorrell. ed.). 19.Halfon P, Munteanu M, Poynard T (2008). "FibroTest-ActiTest as a non-invasive marker of liver fibrosis". Gastroenterol Clin Biol 32 (6): 22-39. 20.Foucher J, Chanteloup E, Vergniol J et al. (2006). "Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study". Gut 55 (3): 403-8. 21.Brenner, David; Richard A. Rippe (2003). Pathogenesis of Hepatic Fibrosis. In Tadataka Yamada. Textbook of Gastroenterology 2 (4th ed.). Lippincott Williams & Wilkins. 22.Giallourakis CC, Rosenberg PM, Friedman LS (2002). The liver in heart failure. Clin Liver Dis 6 (4): 947-67, viii–ix. 23.Heathcote EJ (2003). Primary biliary cirrhosis: historical perspective. Clin Liver Dis 7 (4): 735-40. 24.Masterton GS, Hayes PC (2010). "Coffee and the liver: a potential treatment for liver disease?". Eur J Gastroenterol Hepatol 22 (11): 1277-83. 25.Kamath PS, Kim WR (2007). "The model for end-stage liver disease (MELD)". Hepatology 45 (3): 797-805. 26.Ferrell, B; Connor, SR; Cordes, A; Dahlin, CM; Fine, PG; Hutton, N; Leenay, M; Lentz, J; Person, JL; Meier, DE; Zuroski, K; National Consensus Project for Quality Palliative Care Task Force, Members (2007). "The national agenda for quality palliative care: the National Consensus Project and the National Quality Forum.". Journal of pain and symptom management 33 (6): 737-44. 27.Sanchez, W; Talwalkar, JA (2006). "Palliative care for patients with end-stage liver disease ineligible for liver transplantation.". Gastroenterology clinics of North America 35 (1): 201-19. 28.Poonja, Z; Brisebois, A; van Zanten, SV; Tandon, P; Meeberg, G; Karvellas, CJ (2014). "Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management.". Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association 12 (4): 692-8. 29.Moore KP, Aithal GP (2006). Guidelines on the management of ascites in cirrhosis. Gut. 55 Suppl 6 (Suppl 6): vi1-12. 30.Sundaram V, Shaikh OS (2009). "Hepatic encephalopathy: pathophysiology and emerging therapies". Med. Clin. North Am. 93 (4): 819-36, vii. 31.Ginés P, Arroyo V, Quintero E et al. (1987). "Comparison of paracentesis and diuretics in the treatment of cirrhotics with tense ascites. Results of a randomized study". Gastroenterology 93 (2): 234-41. 32.Kim MY, Choi H, Baik SK et al. (2010). "Portal Hypertensive Gastropathy: Correlation with Portal Hypertension and Prognosis in Cirrhosis". Dig Dis Sci 55 (12): 3561-7. 33.Singal AG, Pillai A, Tiro J (2014). "Early detection, curative treatment, and survival rates for hepatocellular carcinoma surveillance in patients with cirrhosis: a meta-analysis". PLoS Med 11 (4): e1001624. 34.Anderson RN, Smith BL (2003). "Deaths: leading causes for 2001". National Vital Statistics Reports (Centers for Disease Control and Prevention) 52 (9): 1-85. 35.Sørensen HT, Thulstrup AM, Mellemkjar L et al. (2003). Long-term survival and cause-specific mortality in patients with cirrhosis of the liver: a nationwide cohort study in Denmark". Journal of Clinical Epidemiology 56 (1): 88-93. 36.Roguin A (2006). "Rene Theophile Hyacinthe Laënnec (1781-1826): The Man Behind the Stethoscope". Clinical medicine & research 4 (3): 230-5. 37.Lai M, Afdhal NH. Editorial: staging liver fibrosis in hepatitis C: a challenge for this decade. Am J Gastroenterol. 2011;106:2121-2122. [PubMed] 38.Becker L, Salameh W, Sferruzza A, et al. Validation of Hepascore, compared to simple indices of fibrosis, in US patients with chronic hepatitis C virus infection. Clin Gastroenterol Hepatol. 2009;7:696-701. [PubMed] 39.Malik R, Lai M, Sadiq A, et al. Comparison of transient elastography, serum markers and clinical signs for the diagnosis of compensated cirrhosis. J Gastroenterol Hepatol. 2010;25:1562-1568. [PubMed] 40.Pritchett S, Cardenas A, Manning D, Curry M, Afdhal NH. The optimal cutoff for predicting large oesophageal varices using transient elastography is disease specific. J ViralHepat. 2011;18:75-80. [PubMed] 41.Klibansky DA, Mehta SH, Curry M, Nasser I, Challies T, Afdhal NH. Transient elastography for predicting clinical outcomes in patients with chronic liver disease. J Viral Hepat. 2012;19:e184-e193. [PubMed] 42.Manning DS, Afdhal NH. Diagnosis and quantitation of fibrosis. Gastroenterology. 2008;134:1670-1678. [PubMed] 43.Cohen EB, Afdhal NH. Ultrasound-based hepatic elastography: origins, limitations, and applications. J Clin Gastroenterol. 2010;44:637-645. [PubMed] 44.Castera L, Vergniol J, Foucher J, et al. Prospective comparison of transient elastography, Fibrotest, APRI and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology. 2005;128:343-350. [PubMed] 45.Ziol M, Handra-Luca A, Kettaneh A, et al. Non-invasive assessment of liver fibrosis by stiffness measurement: a prospective multicentre study in patients with chronic hepatitis C. Hepatology. 2005;41:48-54. [PubMed] 46.Castera L, Forns X, Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol 2008;48:835-47. Search PubMed 47.Castera L. Non-invasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012;142:1293-302. Search PubMed 48.Kemp W, Roberts S. Feasibility and performance of the FibroScan XL probe. Hepatology 2012;55:1308-9. Search PubMed 49.Castera L, Foucher J, Bernard PH, et al. Pitfalls of liver stiffness measurement: a 5-year prospective study of 13,369 examinations. Hepatology 2010;51:828-35. Search PubMed 50.Robic MA, Procopet B, Metivier S, et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol 2011;55:1017-24. Search PubMed 51.Masuzaki R, Tateishi R, Yoshida H, et al. Prospective risk assessment for hepatocellular carcinoma development in patients with chronic hepatitis C by transient elastography. Hepatology 2009;49:1954-61. Search PubMed 52.Jung KS, Kim SU, Ahn SH, et al. Risk assessment of hepatitis B virus-related hepatocellular carcinoma development using liver stiffness measurement (Fibroscan). Hepatology 2011;53:885-94. Search PubMed 53.Vergniol J, Foucher J, Terrebonne E, et al. Noninvasive tests for fibrosis and liver stiffness predict 5-year outcomes of patients with chronic hepatitis C. Gastroenterology 2011;140:1970-9. Search PubMed 54.Friedrich-Rust M, ong MF, Martens S, et al. Performance of transient elastography for the staging of liver fibrosis: a meta-analysis. Gastroenterology 2008;134:960–74. Search PubMed 55.Tsochatzis EA, Gurusamy KS, Ntaoula S, et al. Elastography for the diagnosis of severity of fibrosis in chronic liver disease: a meta-analysis of diagnostic accuracy. J Hepatol 2011;54:650-9. Search PubMed 56.http://www.myliverexam.com/en/lexamen-fibroscan.html 57.http://hepatitiscnewdrugresearch.com/fibroscan-results-the-scoring-card.html 58.http://www.knscanada.com/?page_id=353 59.http://www.knscanada.com/?page_id=338 60.http://www.knscanada.com/?page_id=359 61.http://www.knscanada.com/ 62.http://www.knscanada.com/?page_id=483 63.http://hepcbc.ca/fibroscan-alternative-to-biopsy/
|